Содержание
- 2. Скорость химической реакции Рассмотрим реакцию взаимодействия оксида углерода(II) и оксида азота(IV). CO + NO2 = CO2
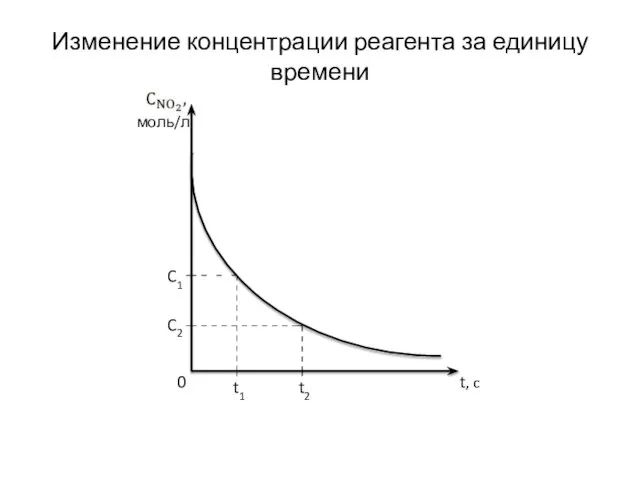
- 3. моль/л t, c 0 C1 C2 t1 t2 Изменение концентрации реагента за единицу времени
- 4. Если известна концентрация NO2 в момент времени t1 и t2, то можно узнать, как быстро она
- 5. Скорость химической реакции – это изменение концентрации реагента или продукта реакции за единицу времени в единице
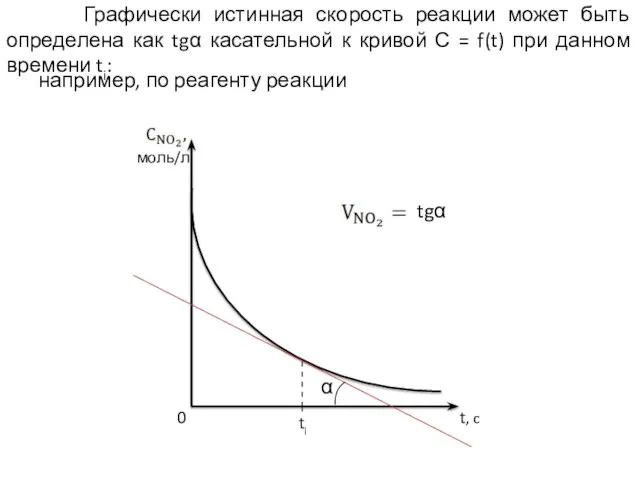
- 6. Графически истинная скорость реакции может быть определена как tgα касательной к кривой С = f(t) при
- 7. Механизм реакции Химические реакции подразделяют на элементарные (одностадийные) и сложные. При элементарной реакции в системе протекает
- 8. Пример: H2 + I2 = 2HI уравнение отображает лишь стехиометрию реакции, но не её механизм. Данная
- 9. Самая медленная стадия называется лимитирующей. Механизмы реакций изучают, чтобы иметь возможность управлять химическими процессами, то есть
- 10. Факторы, влияющие на скорость реакции Скорость реакции зависит от многих факторов: природа и концентрация реагентов; давление
- 11. Влияние концентрации на скорость реакции Основным законом химической кинетики является закон действующих масс (ЗДМ), сформулированный в
- 12. aA + bB = cC + dD вещества стехиометрические коэффициенты - кинетическое уравнение, где - констант
- 13. Показатели степени в кинетическом уравнении называют порядком реакции. 2NO(г) + O2 (г) = 2NO2 (г) Данная
- 14. Влияние температуры на скорость реакции Скорость химических реакций в подавляющем большинстве при повышении температуры возрастает. Например,
- 15. В 1884 г. голландский учёный Я.Х. Вант-Гофф сформулировал правило: при повышении температуры на каждые 10⁰С скорость
- 16. Значительное ускорение реакции при нагревании связано с учащением соударений реагирующих частиц. Не все столкновения частиц оканчиваются
- 17. , где A – предэкспоненциальный множитель или фактор частоты. Показывает долю тех частиц, которые при столкновении
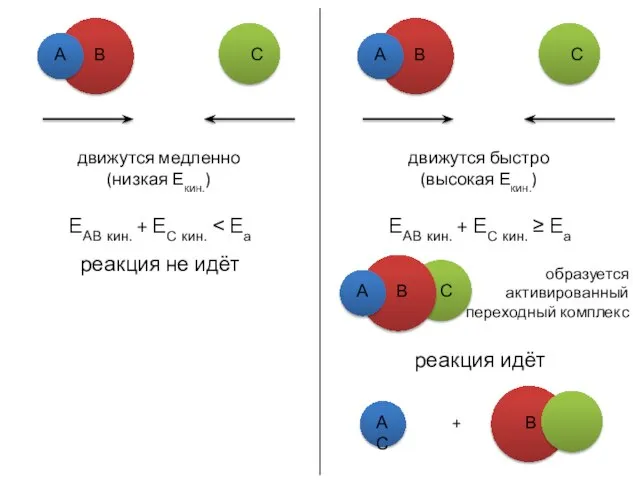
- 18. движутся медленно (низкая Екин.) ЕАВ кин. + ЕС кин. ˂ Еа реакция не идёт А В
- 19. Поскольку в химических реакциях происходит разрыв одних связей и образование других, то энергия активации должна быть
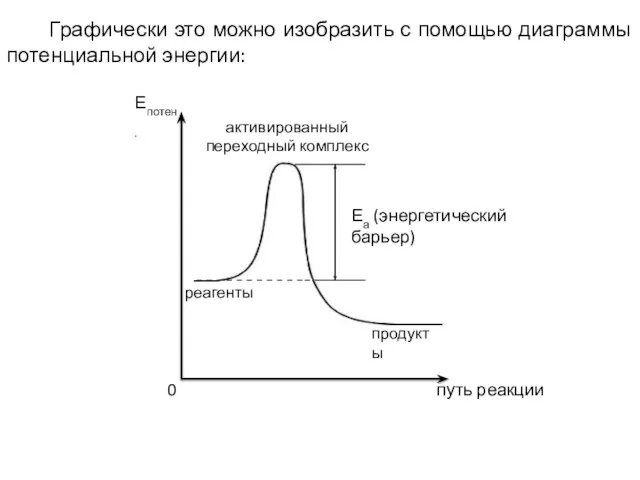
- 20. Графически это можно изобразить с помощью диаграммы потенциальной энергии: путь реакции 0 Епотен. Еа (энергетический барьер)
- 21. Поскольку большинство реакций обратимы, а энергия активации – это энергетический барьер, который отделяет активированный переходный комплекс
- 22. Влияние катализатора на скорость реакции Впервые термин «катализ» ввёл в 1836 г. шведский химик Й.Я. Берцелиус.
- 23. Гомогенный – когда катализатор находится в той же фазе, что и реагенты, и равномерно распределён в
- 24. Вещества могут ускорять химическую реакцию. Такие вещества называют активаторами (или промоторами). Но могут и замедлять скорость
- 26. Скачать презентацию



















 Углеводороды: изомерия
Углеводороды: изомерия Сложные вещества кислоты
Сложные вещества кислоты Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста Астат. Свойства астата
Астат. Свойства астата Сталь. Свойства стали
Сталь. Свойства стали Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Химия нефти и газа
Химия нефти и газа Валентность
Валентность Основания. Равновесия в растворах
Основания. Равновесия в растворах Путешествие в мир удивительных веществ Оксиды. Химия 8 класс
Путешествие в мир удивительных веществ Оксиды. Химия 8 класс Окислительно-восстановительные свойства неорганических кислот
Окислительно-восстановительные свойства неорганических кислот Презентация на тему Предмет химии Вещества
Презентация на тему Предмет химии Вещества  Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Вода-растворитель
Вода-растворитель Комплексные соединения. Аммиакаты
Комплексные соединения. Аммиакаты Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Растворы. 11 класс
Растворы. 11 класс Химические свойства оксидов
Химические свойства оксидов Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Презентация на тему Металлы в организме человека
Презентация на тему Металлы в организме человека  Кислород. Нахождение в природе. Свойства. 8 класс
Кислород. Нахождение в природе. Свойства. 8 класс Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Диеновые углеводороды
Диеновые углеводороды Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Карбоновые кислоты
Карбоновые кислоты Презентация на тему Сложные вопросы ЕГЭ по химии
Презентация на тему Сложные вопросы ЕГЭ по химии