Содержание
- 2. Что изучает химическая кинетика? Химическая кинетика изучает скорости протекания химических процессов и их механизм Основные задачи
- 3. Скорость химической реакции Скорость гомогенной химической реакции (в газовой фазе или в растворе) – это изменение
- 4. Скорость химической реакции Если химическая реакция описывается стехиометрическим уравнением aA + bB → rR + sS
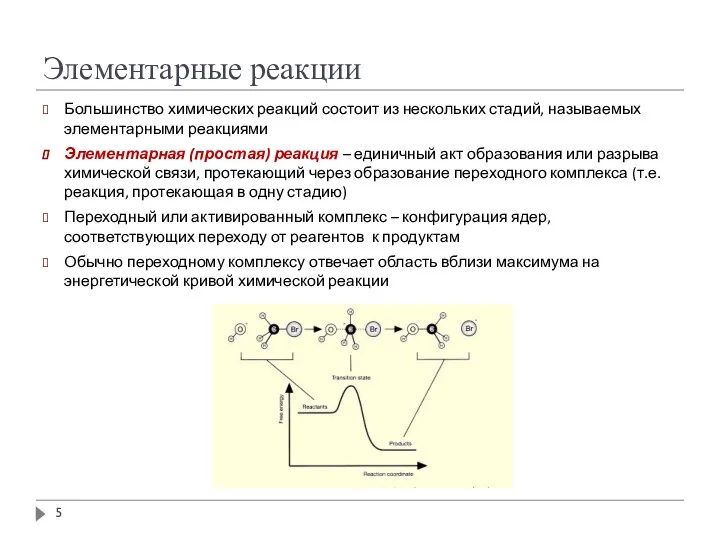
- 5. Элементарные реакции Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями Элементарная (простая) реакция –
- 6. Молекулярность реакции Для характеристики элементарных реакций используют понятие молекулярности реакции Молекулярностью реакции называют число частиц, участвующих
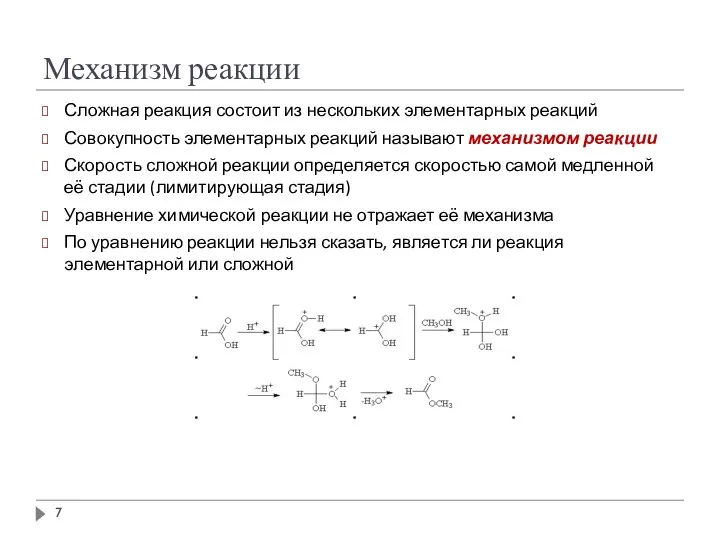
- 7. Механизм реакции Сложная реакция состоит из нескольких элементарных реакций Совокупность элементарных реакций называют механизмом реакции Скорость
- 8. Факторы, влияющие на скорость реакции Природа реагирующих веществ (тип химических связей в молекулах реагентов, прочность связей,
- 9. Постулаты химической кинетики Законы химической кинетики основаны на двух принципах (постулатах): скорость химической реакции пропорциональна концентрациям
- 10. Влияние концентрации реагирующих веществ на скорость реакции Функциональная зависимость скорости химической реакции от концентраций компонентов называется
- 11. Порядок сложной реакции Порядок сложной реакции по веществу в общем случае не совпадает с коэффициентами в
- 12. Реакции нулевого порядка Реакциями нулевого порядка по данному веществу являются реакции в закрытой системе при постоянном
- 13. Примеры реакций нулевого порядка Реакции нулевого порядка встречаются в гетерогенных процессах, гетерогенном катализе и всегда указывают
- 14. Реакции первого порядка Это реакции типа А => продукты Скорость реакции прямо пропорциональна концентрации, т.е. кинетическое
- 15. Реакции первого порядка Особенности реакций первого порядка: Скорость реакции экспоненциально зависит от концентрации График зависимости lnC
- 16. Примеры реакций первого порядка Разложение оксида азота (V) в газовой фазе Разложение ацетона Радиоактивный распад Гидролиз
- 17. Реакции второго порядка В реакции участвуют два реагента Возможны два случая Случай 1. А+В→продукты, начальные концентрации
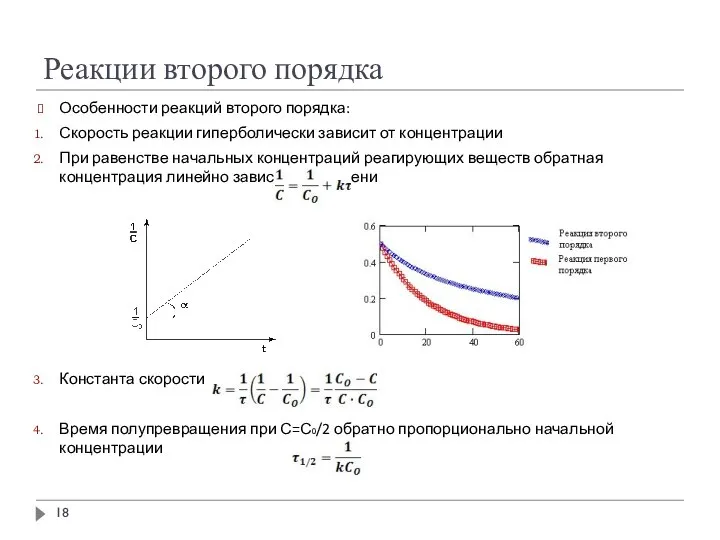
- 18. Реакции второго порядка Особенности реакций второго порядка: Скорость реакции гиперболически зависит от концентрации При равенстве начальных
- 19. Реакции второго порядка Случай 2. А+В→продукты, начальные концентрации веществ не равны, т.е. Кинетическое уравнение Разделяя переменные
- 20. Примеры реакций второго порядка Газофазное разложение иодоводорода Разложение оксида азота (IV) Разложение гипохлорит-иона в растворе Газофазное
- 21. Реакции n-го порядка Это реакции типа nА→продукты Кинетическое уравнение Решение уравнения: Время полупревращения
- 22. Реакции других порядков Необычный — дробный или отрицательный — порядок реакции однозначно указывает на её сложный
- 23. Определение порядка реакции Методы определения порядка реакции базируются на методах вычислительной математики, которые позволяют по кинетическим
- 24. Метод Вант-Гоффа Порядок реакции определяют по скоростям превращения Для реакции А+В→продукты записывают уравнение закона действующих масс:
- 25. Метод подстановки Заключается в том, что экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций
- 26. Метод Оствальда-Нойеса Порядок реакции определяют по времени достижения определённой доли превращения α: Отсюда порядок реакции
- 27. Метод полупревращения Частный случай метода Оствальда-Нойеса Порядок реакции определяют по периоду полупревращения (α=1/2) Метод Оствальда-Нойеса и
- 28. Влияние температуры на скорость реакции Скорость большинства реакций увеличивается с ростом температуры, т.к. при этом возрастает
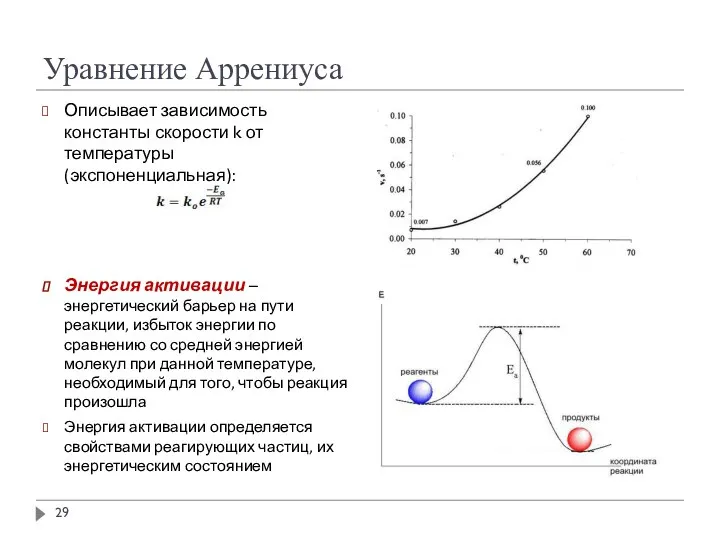
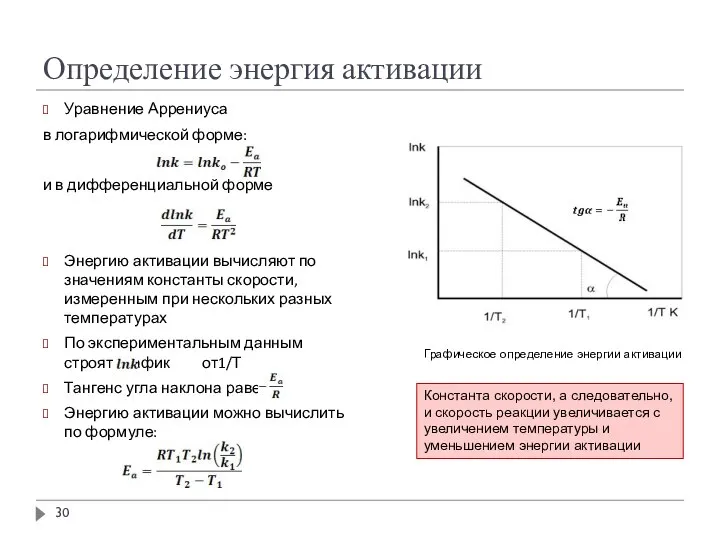
- 29. Уравнение Аррениуса Описывает зависимость константы скорости k от температуры (экспоненциальная): Энергия активации – энергетический барьер на
- 30. Определение энергия активации Уравнение Аррениуса в логарифмической форме: и в дифференциальной форме Энергию активации вычисляют по
- 31. Аномальная зависимость константы скорости от температуры Характерна для некоторых реакций третьего порядка, ферментативных и цепных реакций
- 32. Кинетика сложных реакций При изучении сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций:
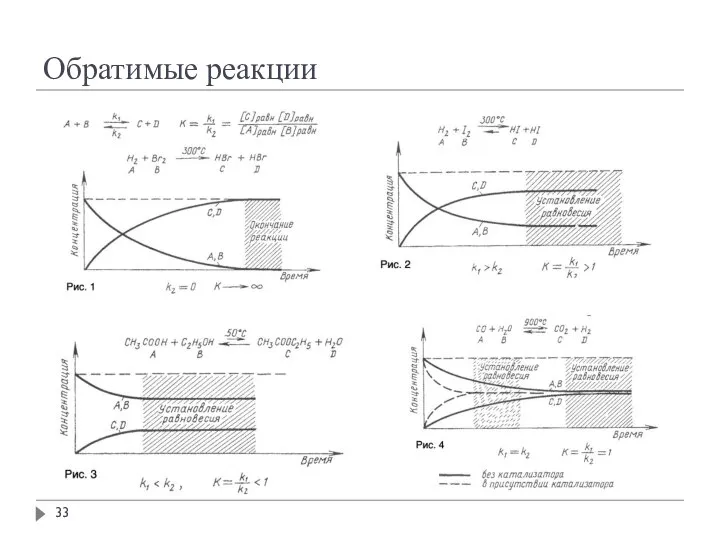
- 33. Обратимые реакции
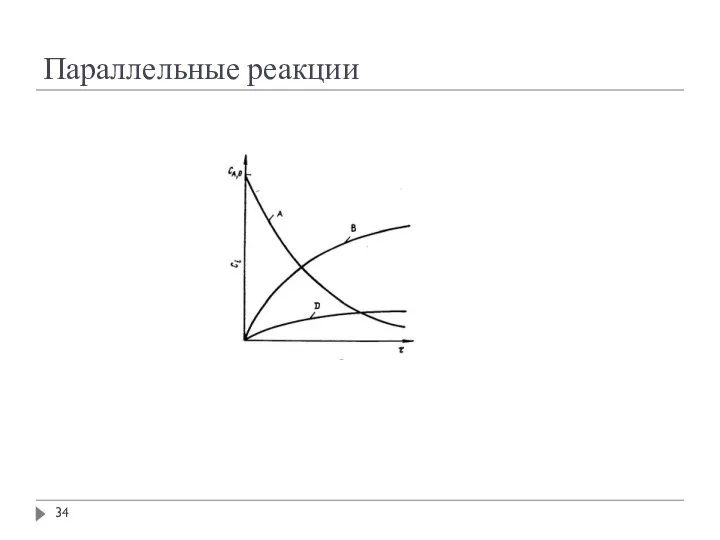
- 34. Параллельные реакции
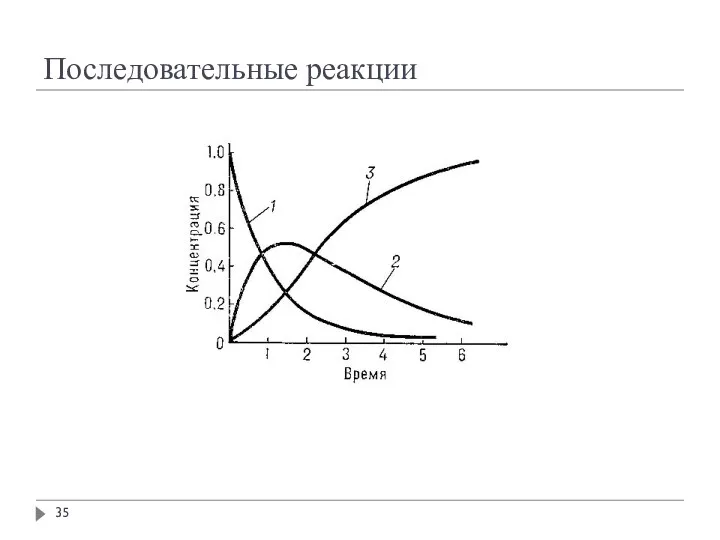
- 35. Последовательные реакции
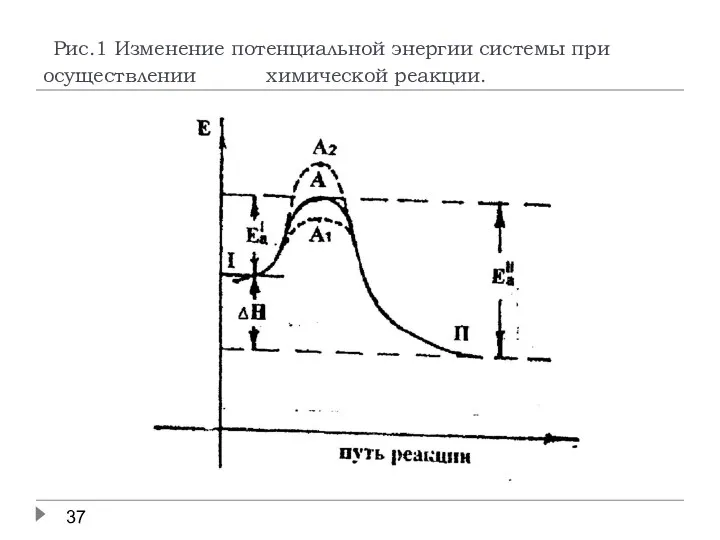
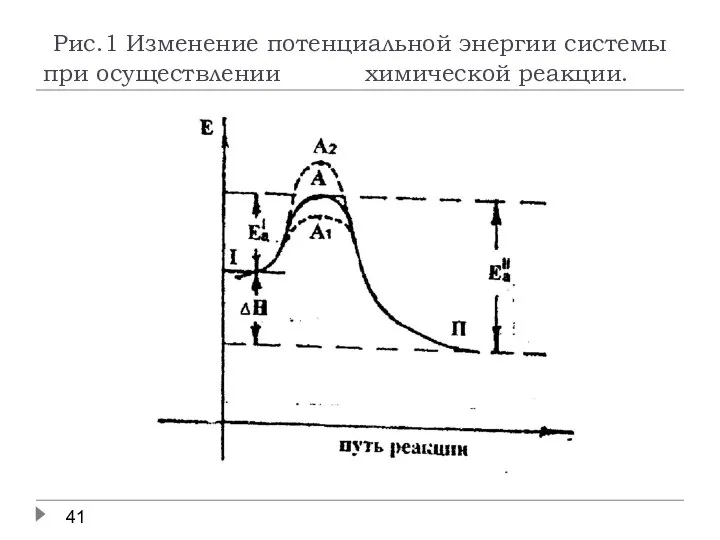
- 36. Катализ. Увеличение скорости каталитической реакции связано с уменьшением энергии переходного состояния системы (точка А1 на рис.1),
- 37. Рис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.
- 38. Например, реакция А + В → А … В → А В активированный комплекс в присутствии
- 39. При гетерогенном катализе скорость реакции зависит от площади поверхности катализатора (обычно в промышленности применяют твердые катализаторы:
- 40. Механизм гетерогенного катализа очень сложен и зависит от природы реакции. Все каталитические гетерогенные реакции включают в
- 41. Рис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.
- 43. Скачать презентацию






























 Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Путешествие в мир кислот
Путешествие в мир кислот Азот N2
Азот N2 Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение  Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Номенклатура органических соединений
Номенклатура органических соединений Нихром. Физические свойства
Нихром. Физические свойства Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Мыло. Интересно об известном
Мыло. Интересно об известном Электролитическая диссоциация
Электролитическая диссоциация Аммиак. Состав вещества
Аммиак. Состав вещества Циклические эфиры (окиси)
Циклические эфиры (окиси) Строение атома
Строение атома Нанокристаллические и аморфные металлы и сплавы
Нанокристаллические и аморфные металлы и сплавы Презентация на тему Благородные газы
Презентация на тему Благородные газы  Степени окисления и формулы веществ
Степени окисления и формулы веществ Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты Кислоты
Кислоты Углеводороды
Углеводороды Интерактивный плакат Алканы
Интерактивный плакат Алканы Фосфор туралы
Фосфор туралы Неметаллы – химические элементы
Неметаллы – химические элементы Класс оксиды
Класс оксиды Золото (Au)
Золото (Au) Кристаллы
Кристаллы Количество вещества. Моль
Количество вещества. Моль Презентация на тему Применение солей
Презентация на тему Применение солей