Содержание
- 2. 1)Обобщить сведения о различных видах химических связей и типах кристаллических решеток. 2)Повторить схемы образования веществ с
- 3. Благородные газы-элементы 8 гр.главной подгруппы. He, Ne, Ar, Kr, Xe, Rn –одноатомны 1s2 ns2 np 6
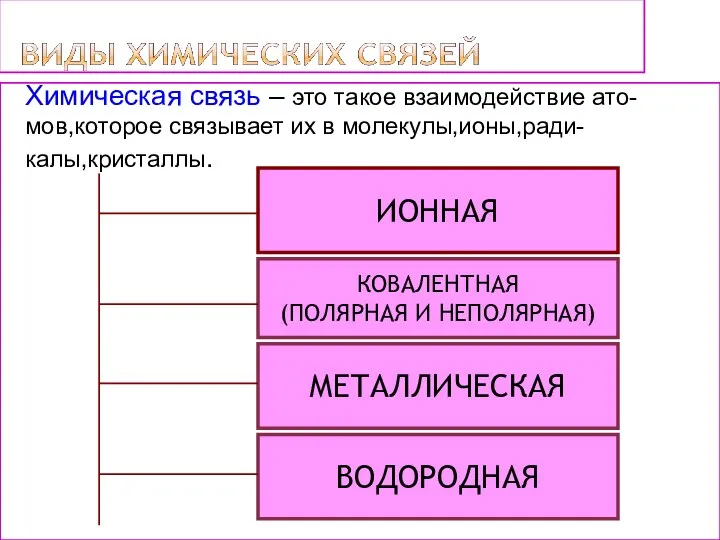
- 4. ИОННАЯ МЕТАЛЛИЧЕСКАЯ КОВАЛЕНТНАЯ (ПОЛЯРНАЯ И НЕПОЛЯРНАЯ) ВОДОРОДНАЯ Химическая связь – это такое взаимодействие ато- мов,которое связывает
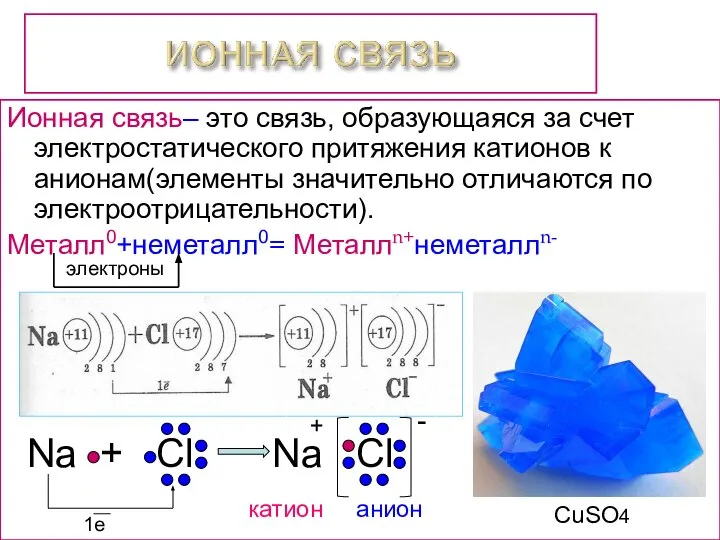
- 5. - Na + Cl Na Cl Ионная связь– это связь, образующаяся за счет электростатического притяжения катионов
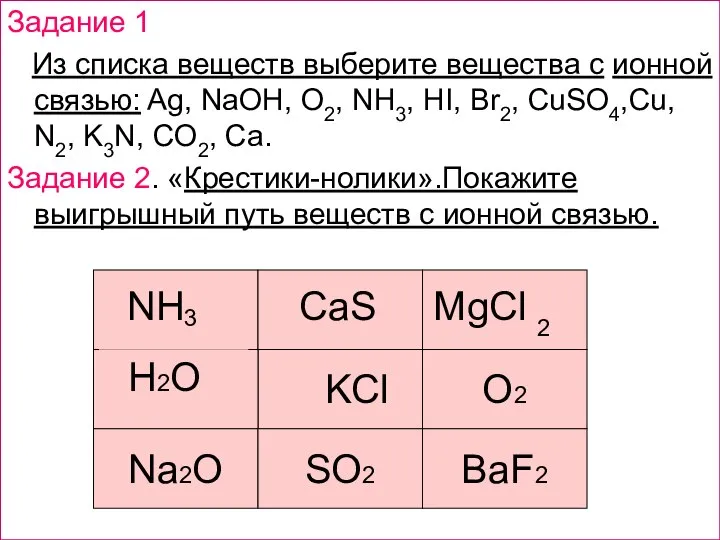
- 6. Задание 1 Из списка веществ выберите вещества с ионной связью: Ag, NaOH, O2, NH3, HI, Br2,
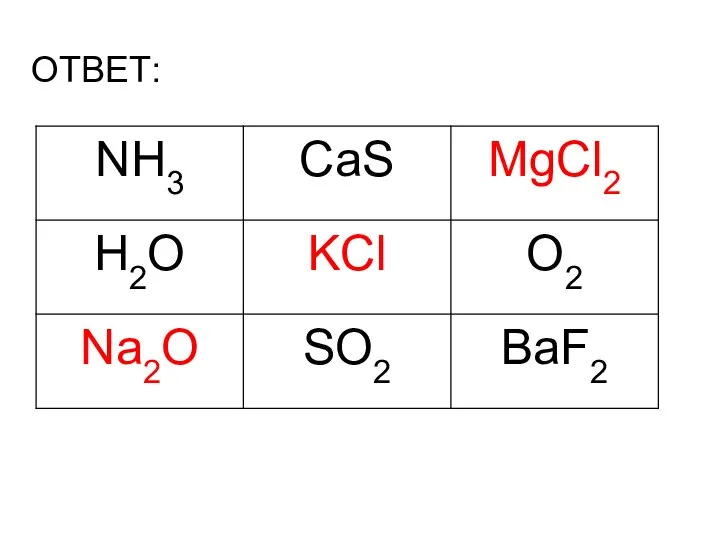
- 7. ОТВЕТ:
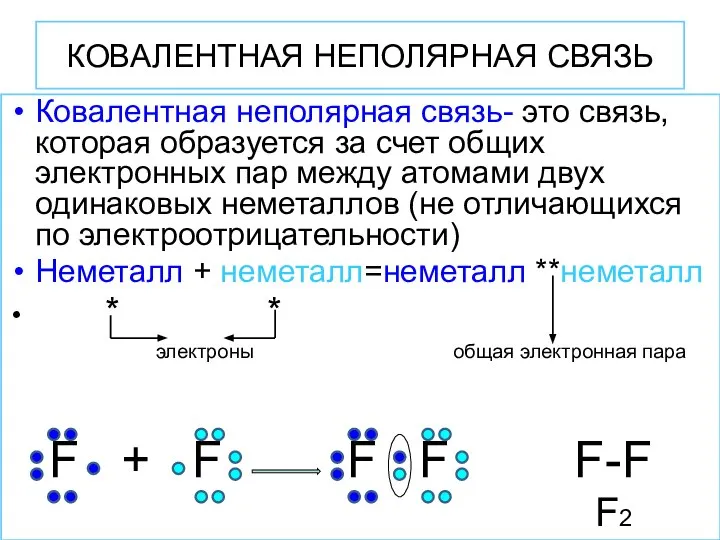
- 8. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ Ковалентная неполярная связь- это связь, которая образуется за счет общих электронных пар между
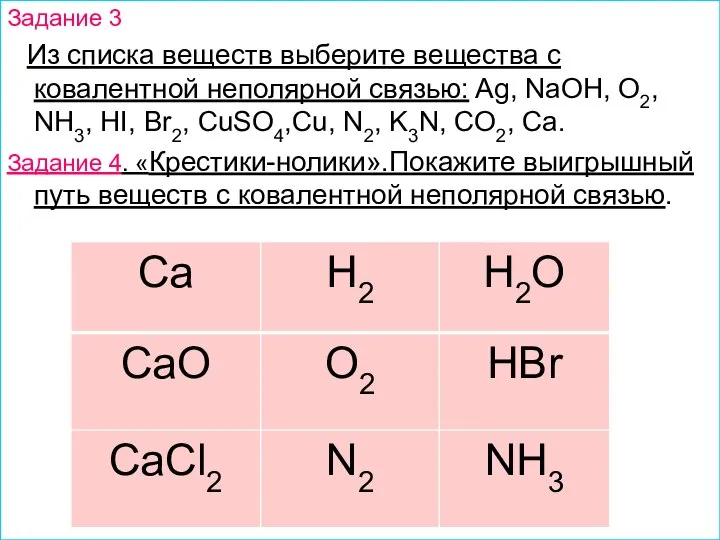
- 9. Задание 3 Из списка веществ выберите вещества с ковалентной неполярной связью: Ag, NaOH, O2, NH3, HI,
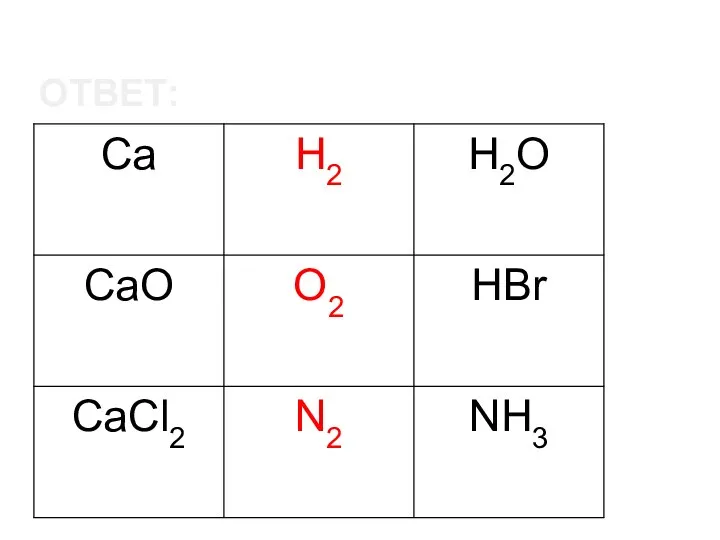
- 10. ОТВЕТ:
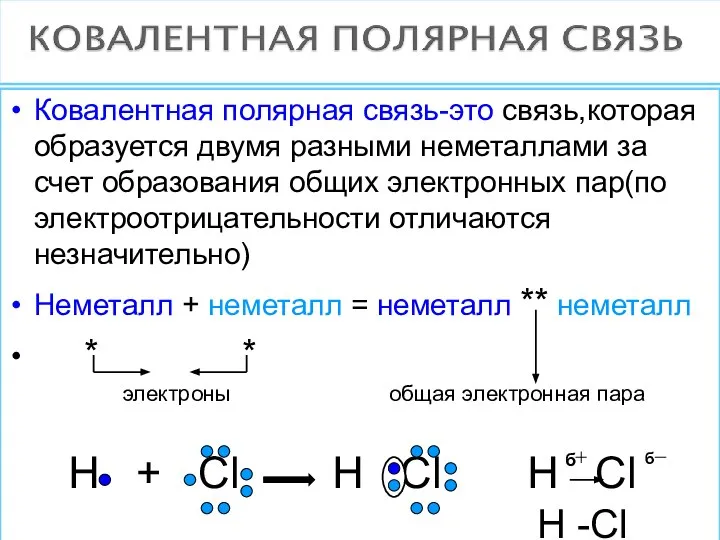
- 11. Ковалентная полярная связь-это связь,которая образуется двумя разными неметаллами за счет образования общих электронных пар(по электроотрицательности отличаются
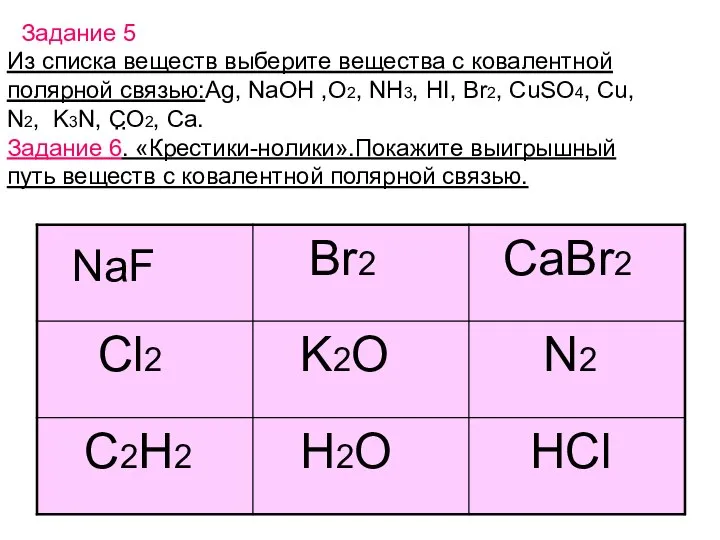
- 12. Из списка веществ выберите вещества с ковалентной полярной связью:Ag, NaOH ,O2, NH3, HI, Br2, CuSO4, Cu,
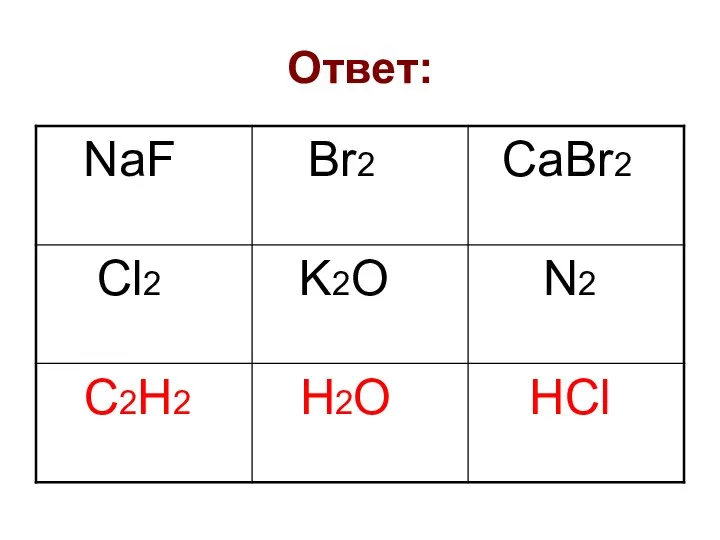
- 13. Ответ:
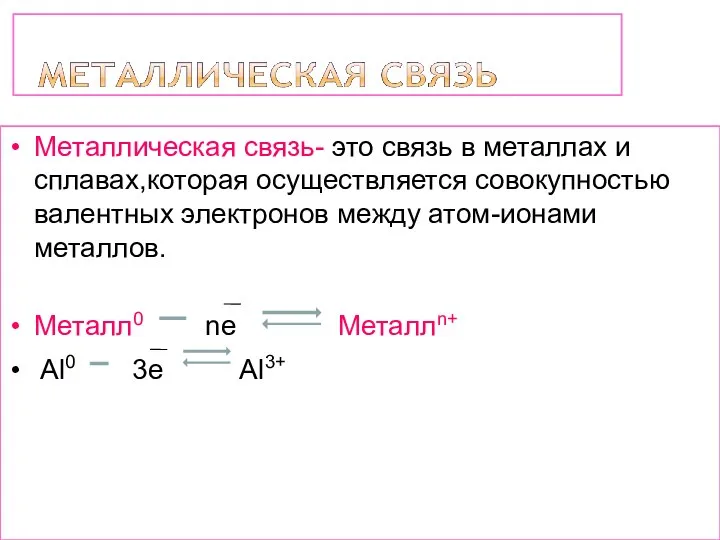
- 14. Металлическая связь- это связь в металлах и сплавах,которая осуществляется совокупностью валентных электронов между атом-ионами металлов. Металл0
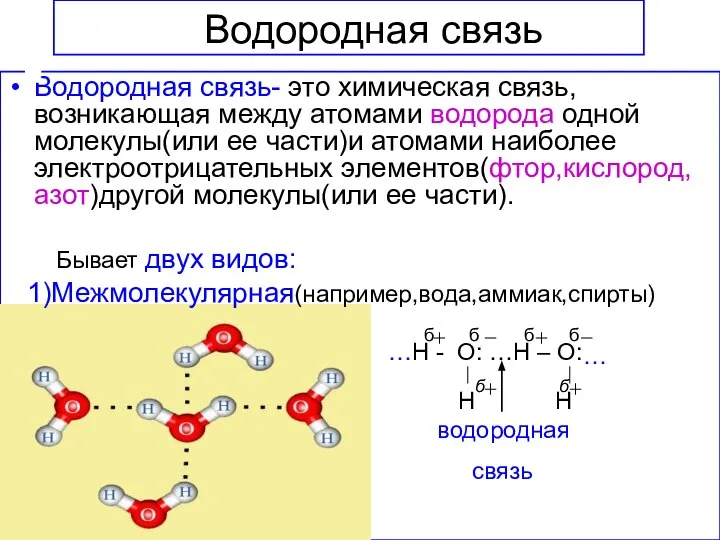
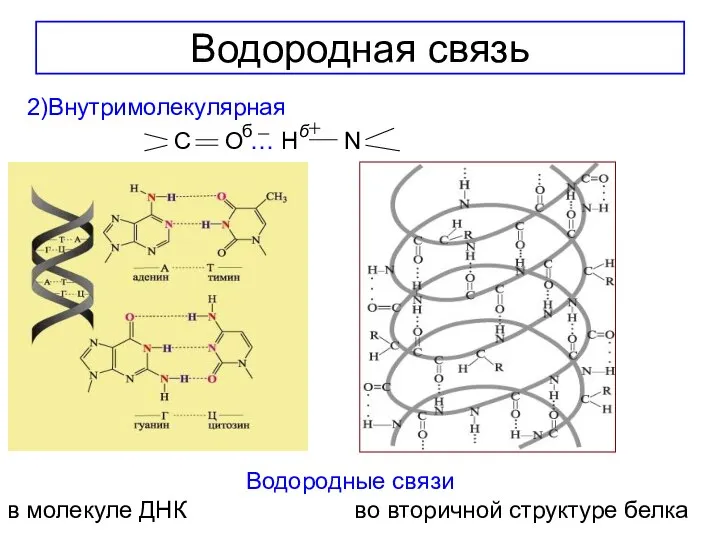
- 15. Водородная связь Водородная связь- это химическая связь,возникающая между атомами водорода одной молекулы(или ее части)и атомами наиболее
- 16. Водородная связь 2)Внутримолекулярная C O … H N б б Водородные связи в молекуле ДНК во
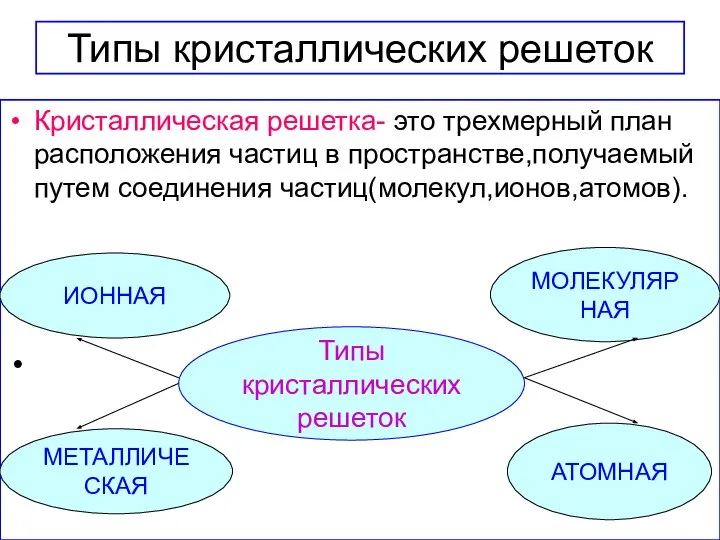
- 17. Типы кристаллических решеток Кристаллическая решетка- это трехмерный план расположения частиц в пространстве,получаемый путем соединения частиц(молекул,ионов,атомов). Типы
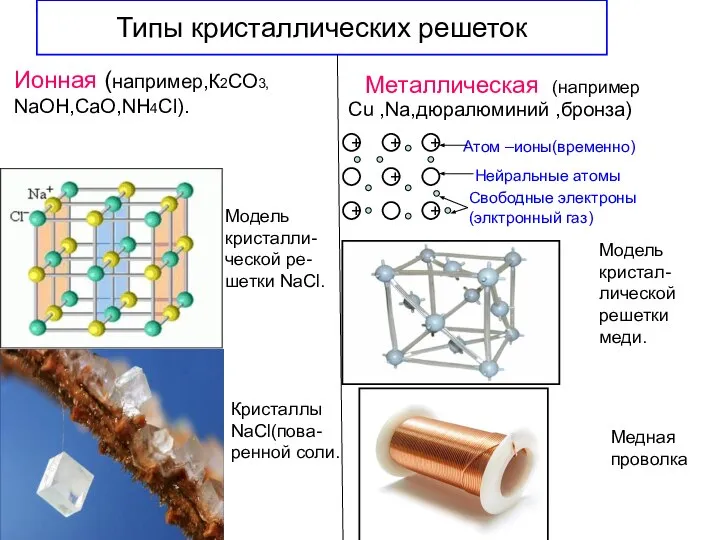
- 18. Типы кристаллических решеток Металлическая Ионная (например,К2СО3, NaOH,СаО,NH4Cl). (например Cu ,Na,дюралюминий ,бронза) Модель кристалли- ческой ре- шетки
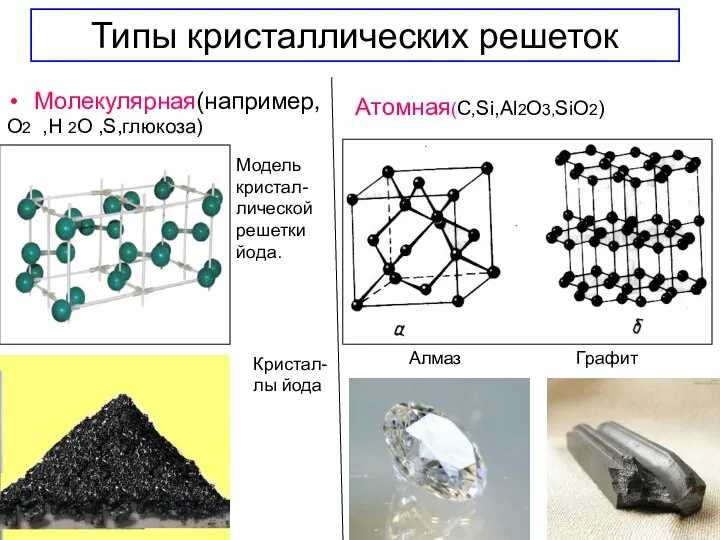
- 19. Типы кристаллических решеток Молекулярная(например, О2 ,Н 2О ,S,глюкоза) Модель кристал- лической решетки йода. Кристал- лы йода
- 20. Задание 7: Загадки.Отгадайте,о каких кристаллических решетках(к.р.) идет речь? 1)И прочностью своей они свой горды- Но только
- 21. Сравнение различных видов химических связей Сходство:1)физическая природа всех видов связей –электронно- ядерное взаимодействие,сопровожда- ющееся выделением энергии.
- 22. Выводы: 1)Атомы образуют химические связи,чтобы приобрести устойчивую 8 электронную конфигурацию внешнего энергетического уровня. 2)В образовании связей
- 23. Домашнее задание Составить кроссворд из 10 слов (пять слов по вертикали и пять по горизонтали) по
- 25. Скачать презентацию






 Семь доисторических металлов
Семь доисторических металлов Соли. Определение, состав, классификация, физические свойства, применение
Соли. Определение, состав, классификация, физические свойства, применение Современные химические топливные элементы
Современные химические топливные элементы Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Классификация пластмасс. Свойства и применение пластмасс
Классификация пластмасс. Свойства и применение пластмасс Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Схема интеграции пентозофосфатного шунта с гликолизом
Схема интеграции пентозофосфатного шунта с гликолизом Косметические средства. Виды, состав и влияние на организм
Косметические средства. Виды, состав и влияние на организм Неметаллы. Обобщение и систематизация знаний
Неметаллы. Обобщение и систематизация знаний Синтез ланшенгенина дэ
Синтез ланшенгенина дэ Признаки химических реакций
Признаки химических реакций Порядок констант ССВ JHH в бензоле. Задачи
Порядок констант ССВ JHH в бензоле. Задачи Спирты. Строение, классификация, изомерия, физические свойства
Спирты. Строение, классификация, изомерия, физические свойства Состояния вещества. Тест. 5 класс
Состояния вещества. Тест. 5 класс Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул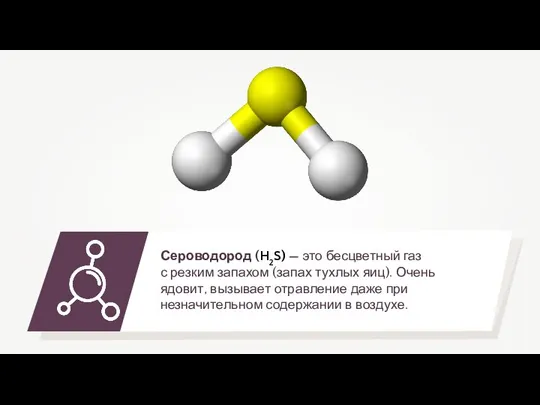 Сероводород
Сероводород Магний и его сплавы
Магний и его сплавы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Олеиновая кислота
Олеиновая кислота Средства декоративной косметики
Средства декоративной косметики Презентация на тему Химия и сельское хозяйство Пестициды
Презентация на тему Химия и сельское хозяйство Пестициды  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основания, их состав и название. Класс: 8 Учитель: Морухнова Ольга Ивановна
Основания, их состав и название. Класс: 8 Учитель: Морухнова Ольга Ивановна Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы Слабые и сильные электролиты
Слабые и сильные электролиты