Содержание
- 2. ПОЧЕМУ АТОМЫ ВЗАИМОДЕЙСТВУЮТ МЕЖДУ СОБОЙ? Что такое химическая связь? Каждый атом стремится к завершению своей наружной
- 3. ПОД ХИМИЧЕСКОЙ СВЯЗЬЮ ПОНИМАЮТ ТАКОЕ ВЗАИМОДЕЙСТВИЕ АТОМОВ, КОТОРОЕ СВЯЗЫВАЕТ ИХ В МОЛЕКУЛЫ, ИОНЫ, РАДИКАЛЫ, КРИСТАЛЛЫ
- 4. КАК ОПРЕДЕЛИТЬ ЧИСЛО ЭЛЕКТРОНОВ НА НАРУЖНОМ СЛОЕ АТОМОВ ЭЛЕМЕНТОВ ГЛАВНЫХ ПОДГРУПП? Число электронов = номеру группы.
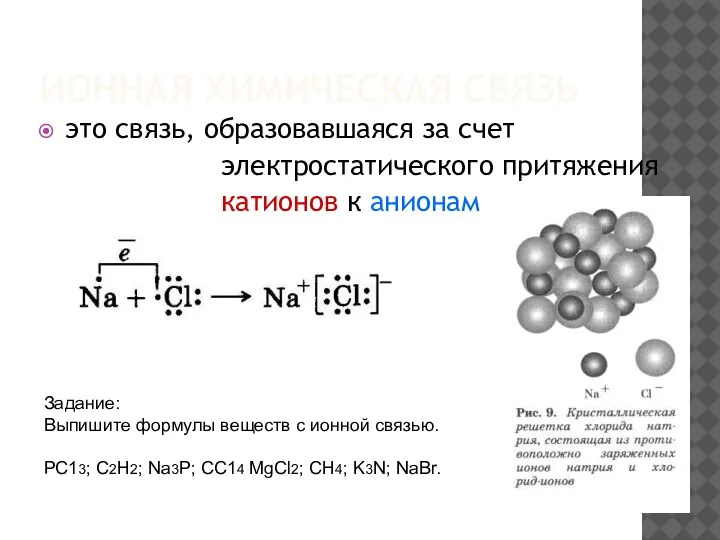
- 5. ИОННАЯ ХИМИЧЕСКАЯ СВЯЗЬ это связь, образовавшаяся за счет электростатического притяжения катионов к анионам Задание: Выпишите формулы
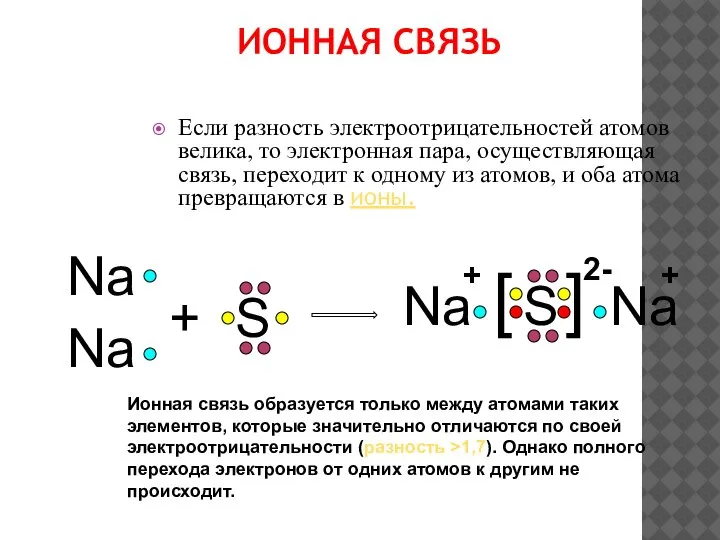
- 6. ИОННАЯ СВЯЗЬ Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из
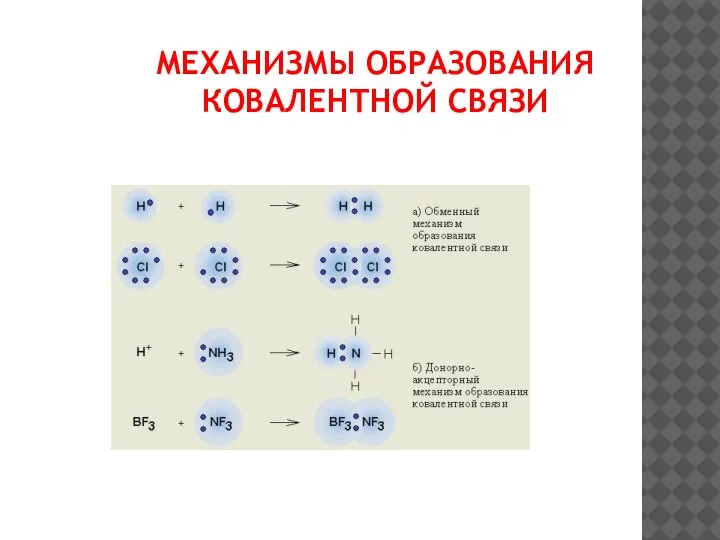
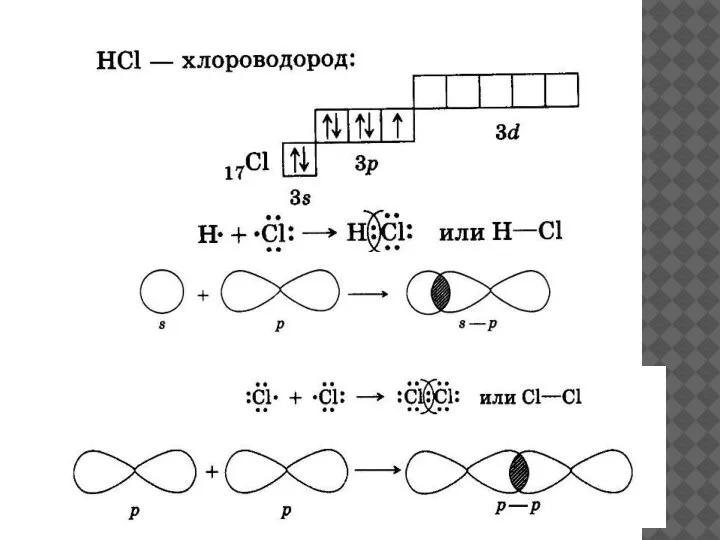
- 7. МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ
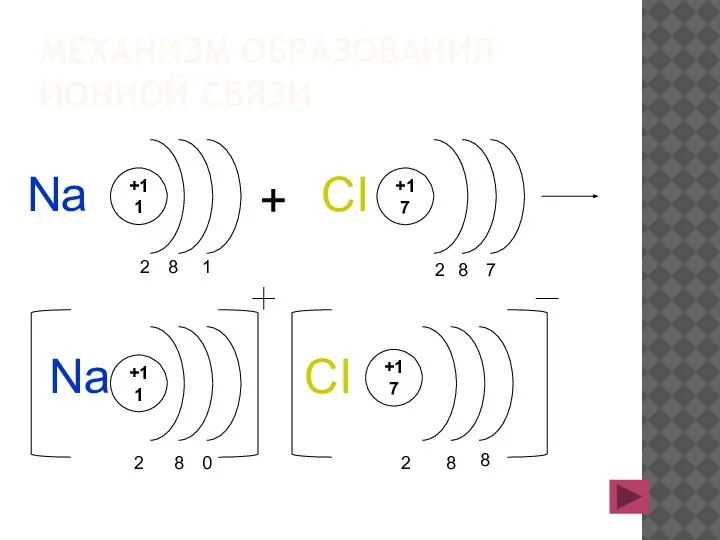
- 8. МЕХАНИЗМ ОБРАЗОВАНИЯ ИОННОЙ СВЯЗИ +11 0 8 2 +17 8 2 + Na Na +11 2
- 9. Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в
- 10. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА. Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Образуя единое
- 12. КОВАЛЕНТНАЯ ХИМИЧЕСКАЯ СВЯЗЬ это связь, возникающая между атомами за счет образования общих электронных пар Обменный Донорно-акцепторный
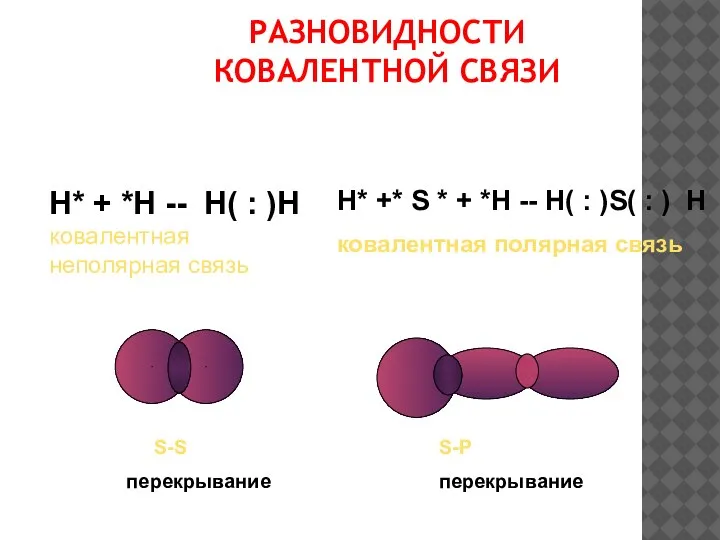
- 13. РАЗНОВИДНОСТИ КОВАЛЕНТНОЙ СВЯЗИ Н* + *Н -- Н( : )Н ковалентная неполярная связь Н* +* S
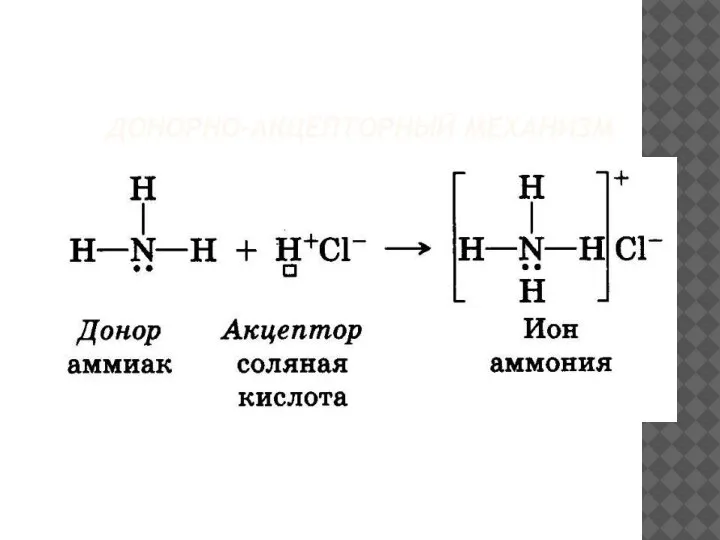
- 15. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ
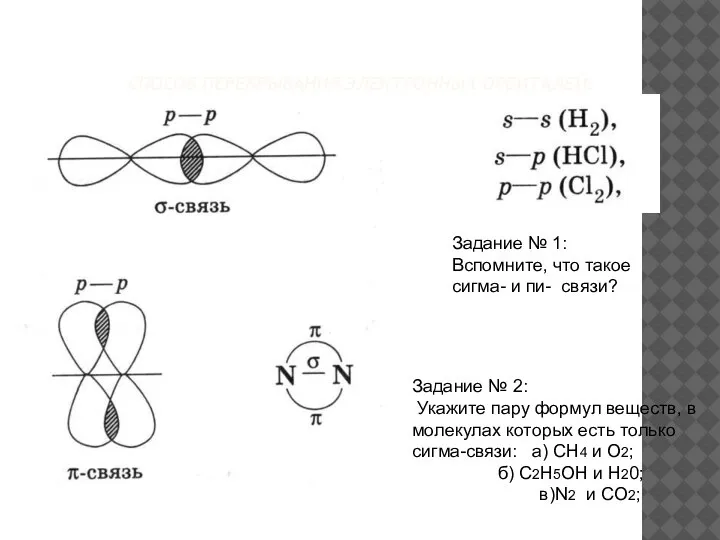
- 16. СПОСОБ ПЕРЕКРЫВАНИЯ ЭЛЕКТРОННЫХ ОРБИТАЛЕЙ: Задание № 1: Вспомните, что такое сигма- и пи- связи? Задание №
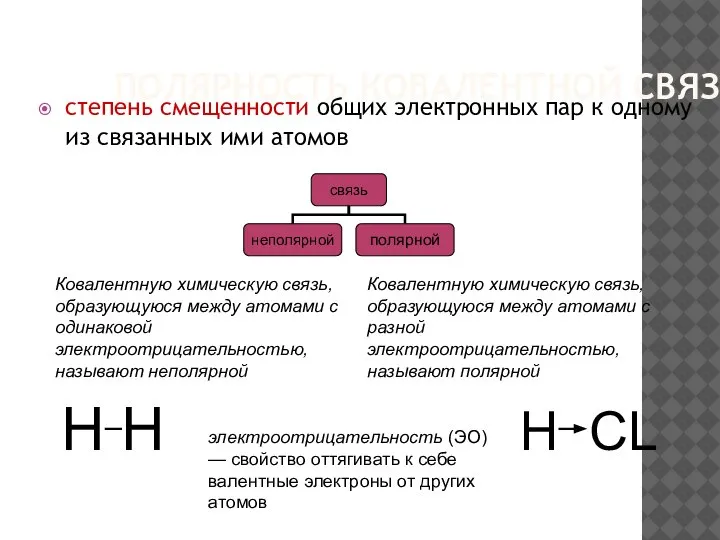
- 17. ПОЛЯРНОСТЬ КОВАЛЕНТНОЙ СВЯЗИ степень смещенности общих электронных пар к одному из связанных ими атомов электроотрицательность (ЭО)
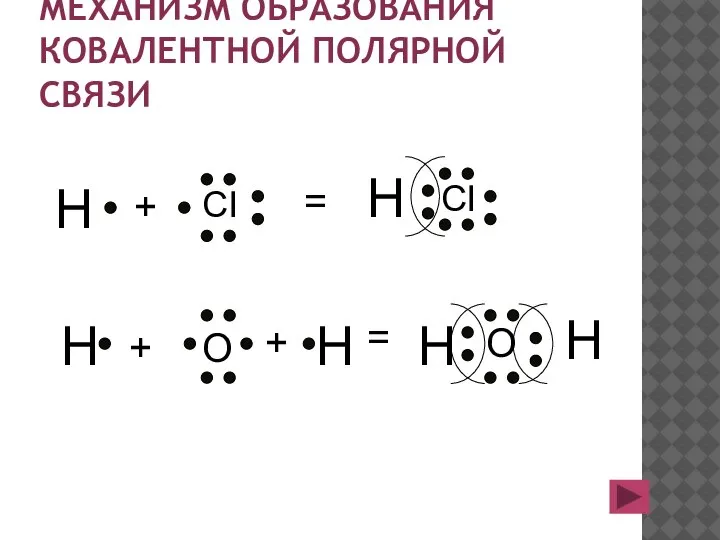
- 18. МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗИ H CI + = H CI H O H H H
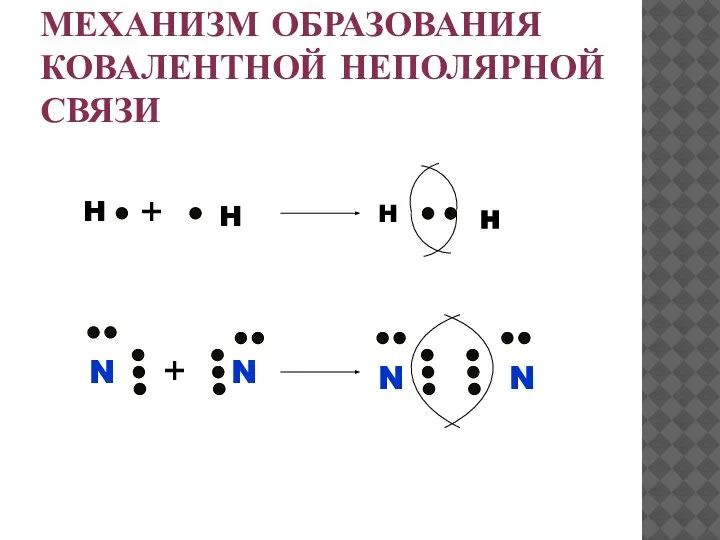
- 19. МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ СВЯЗИ H H N N H H N N + +
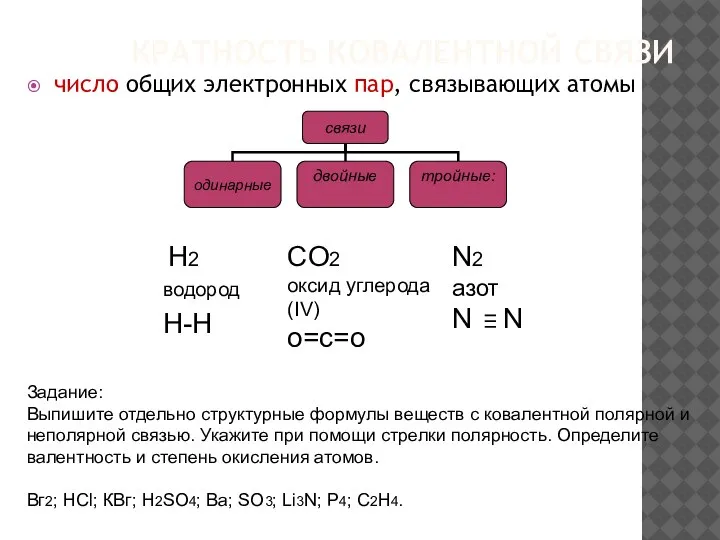
- 20. КРАТНОСТЬ КОВАЛЕНТНОЙ СВЯЗИ число общих электронных пар, связывающих атомы CO2 оксид углерода (IV) о=с=о N2 азот
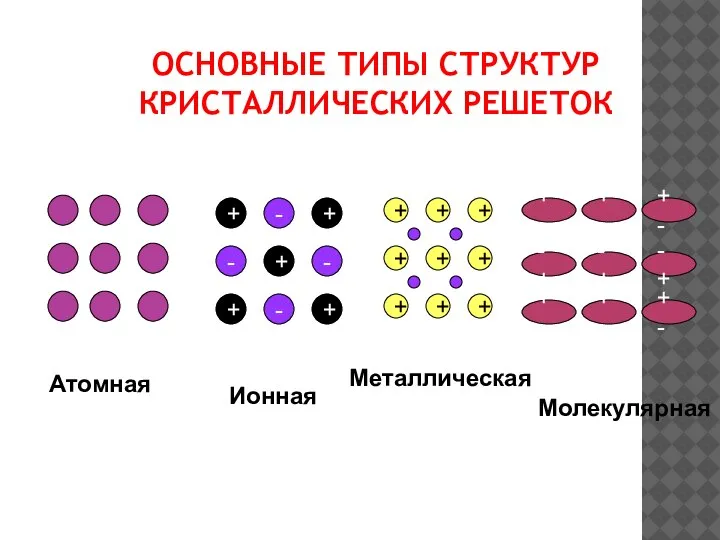
- 21. ОСНОВНЫЕ ТИПЫ СТРУКТУР КРИСТАЛЛИЧЕСКИХ РЕШЕТОК + + - + - + + - - + +
- 22. ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (SiO2). Они состоят из атомов, связанных друг
- 23. ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. ВЕЩЕСТВА ЛЕГКОПЛАВКИ,
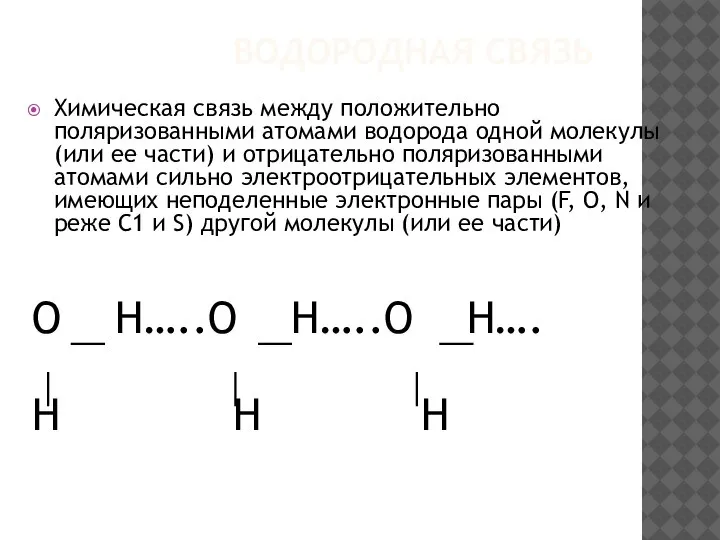
- 24. ВОДОРОДНАЯ СВЯЗЬ Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно
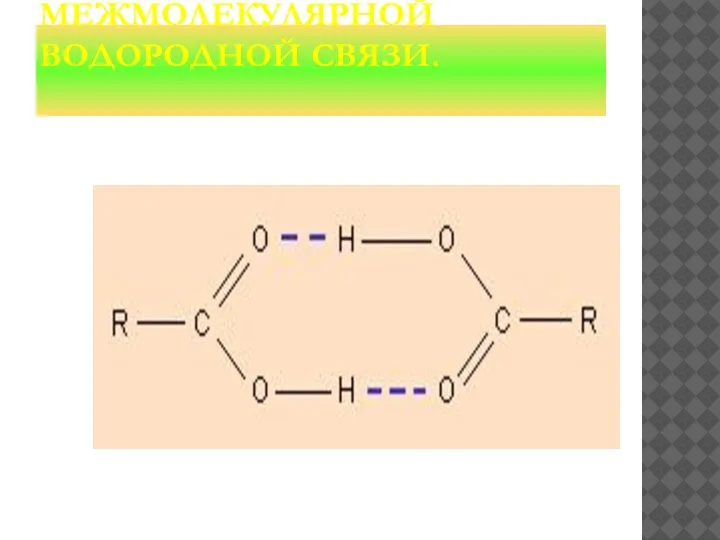
- 25. ОБРАЗОВАНИЕ МЕЖМОЛЕКУЛЯРНОЙ ВОДОРОДНОЙ СВЯЗИ.
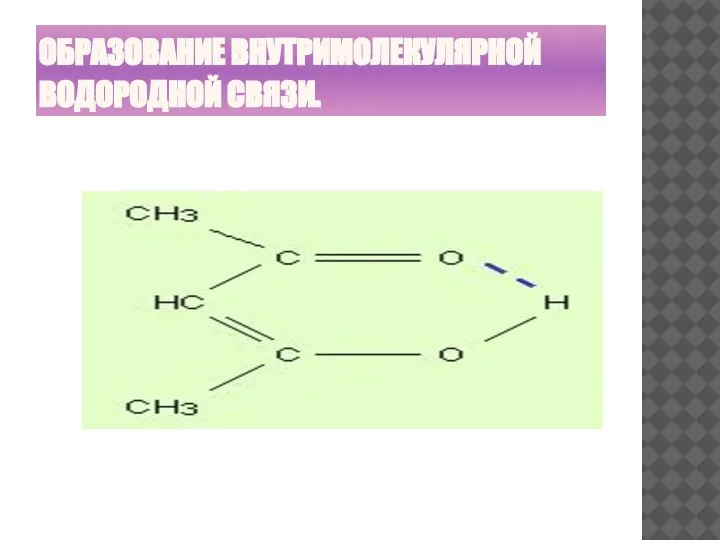
- 26. ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНОЙ ВОДОРОДНОЙ СВЯЗИ.
- 27. МЕХАНИЗМ ОБРАЗОВАНИЯ ВОДОРОДНОЙ СВЯЗИ ИМЕЕТ ЧАСТИЧНО ЭЛЕКТРОСТАТИЧЕСКИЙ, ЧАСТИЧНО ДОНОРНО-АКЦЕПТОРНЫЙ ХАРАКТЕР. ПРИМЕРЫ МЕЖМОЛЕКУЛЯРНОЙ ВОДОРОДНОЙ СВЯЗИ:
- 29. Скачать презентацию










 Перегонка. Вклад алхимиков в органическую химию
Перегонка. Вклад алхимиков в органическую химию Классификация неорганический веществ
Классификация неорганический веществ Ода стеклу и городу-герою Керчи
Ода стеклу и городу-герою Керчи Ртуть
Ртуть Ovr-1
Ovr-1 Металлы
Металлы Ископаемые углеводороды
Ископаемые углеводороды Две стороны личности: композитор и ученый-химик
Две стороны личности: композитор и ученый-химик Решение турнира. 9 класс
Решение турнира. 9 класс Металлы II А подгруппы
Металлы II А подгруппы Реакция хлорметилирования
Реакция хлорметилирования Алканы
Алканы Введение в материаловедение
Введение в материаловедение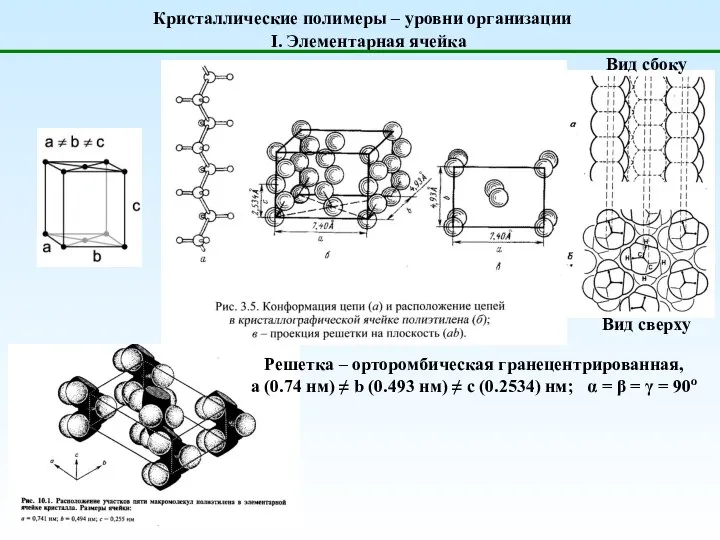 Структура-полимеров
Структура-полимеров Квантовая химия
Квантовая химия Тяжелая вода
Тяжелая вода Электролитическая диссоциация
Электролитическая диссоциация Нанохімія та основи нанотехнологій
Нанохімія та основи нанотехнологій Викторин. Диалог химии и медицины
Викторин. Диалог химии и медицины Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Витамины. (10 класс)
Витамины. (10 класс) Lektsia_6
Lektsia_6 Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Строение бензола
Строение бензола Pастворы, используемые в промышленности
Pастворы, используемые в промышленности Презентация на тему Вычисления массовой доли растворенного вещества
Презентация на тему Вычисления массовой доли растворенного вещества  Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Конкурс О, химия – ты муза вдохновения!
Конкурс О, химия – ты муза вдохновения!