Содержание
- 3. Номенклатура. Изомерия.
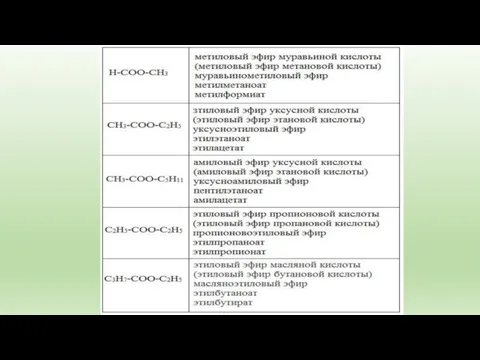
- 4. Сокращенный вариант первым указывается название радикала R, присоединенного к кислоте, затем – название кислоты (корень слова)
- 5. Полный вариант. К названию радикала R (по систематической номенклатуре) добавляется суффикс «овый», затем вставляется слово "эфир"
- 6. 2. Тривиальное название: к названию радикала R добавляется тривиальное название остатка кислоты (используется суффикс "ат"): -
- 8. Для сложных эфиров карбоновых кислот характерны следующие виды изомерии: 1. Изомерия углеродной цепи (углеродного скелета) например,
- 9. Физические свойства Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие жидкости, многие из которых
- 11. Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества, не имеют запаха, в воде не
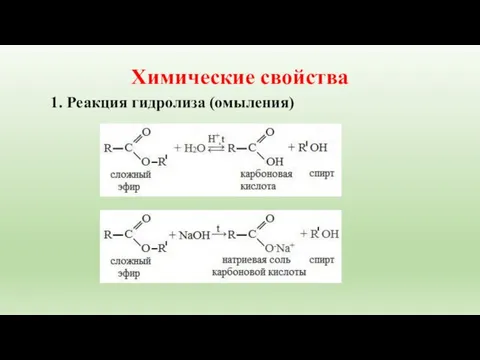
- 12. Химические свойства 1. Реакция гидролиза (омыления)
- 13. 2. Реакция присоединения Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям
- 14. 4. Реакция образования амидов Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
- 15. 5. Реакция горения
- 16. ПОЛУЧЕНИЕ
- 17. 1 способ Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами
- 18. видео
- 19. 2 способ
- 20. 3 способ
- 21. 4 способ
- 22. 5 способ
- 23. ЖИРЫ относятся к большой химически разнородной группе соединений - ЛИПИДАМ (группа природных нерастворимых в воде соединений)
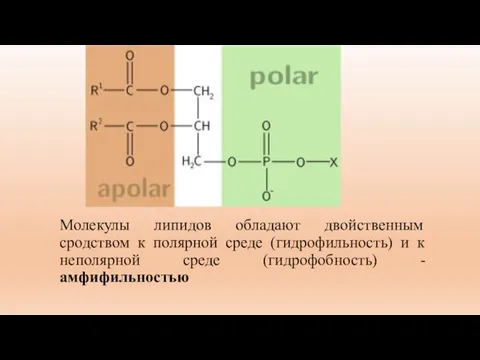
- 24. Молекулы липидов обладают двойственным сродством к полярной среде (гидрофильность) и к неполярной среде (гидрофобность) - амфифильностью
- 25. ЖИРЫ ИЛИ ТРИАЦИЛГЛИЦЕРИНЫ ЭТО СЛОЖНЫЕ ЭФИРЫ ГЛИЦЕРИНА И КАРБОНОВЫХ КИСЛОТ
- 26. Схема получения жиров
- 27. Простые и смешанные жиры
- 28. Условные знаки для обозначения жиров Известно более 70 карбоновых кислот, входящих в состав жиров Большая часть
- 29. Наиболее важные незаменимые полиненасыщенные жирные кислоты: линолевая 18:2, ∆9, 12 омега – 6 С17Н31СООН линоленовая 18:3,
- 30. Физические свойства Растительные жиры – масла, имеют температуру плавления ниже 0о С : оливковое масло -6о
- 31. Химические свойства 1 . Гидролиз
- 33. 2 . Гидрирование
- 35. Скачать презентацию





























 Окислительно-восстановительные реакции. ОГЭ по химии, задание 15
Окислительно-восстановительные реакции. ОГЭ по химии, задание 15 Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Классификация веществ
Классификация веществ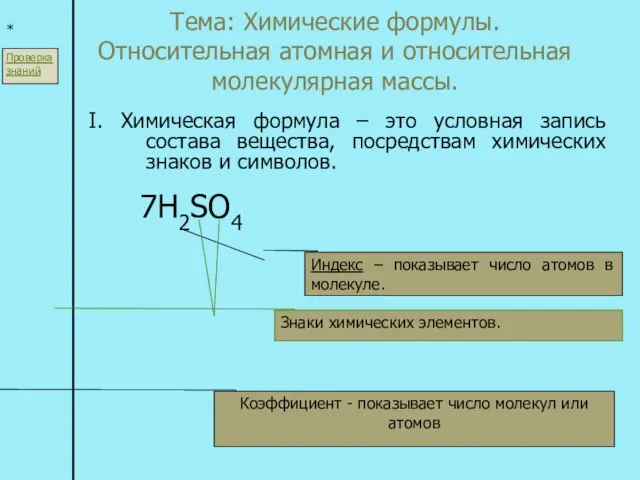 Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Оксидті шикізаттан темір ұнтағын алу технологиясын жасау
Оксидті шикізаттан темір ұнтағын алу технологиясын жасау Тотығу - тотықсыздану реакциясы
Тотығу - тотықсыздану реакциясы Химическая викторина
Химическая викторина Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Презентация на тему Полисахариды
Презентация на тему Полисахариды  Растворы
Растворы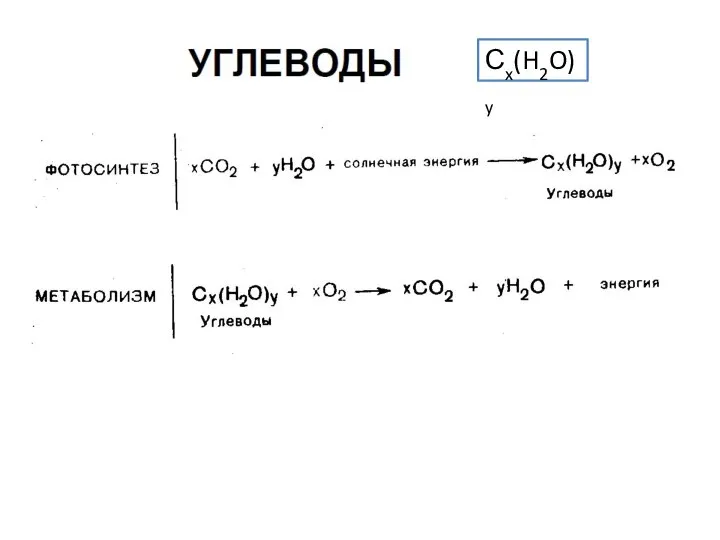 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Презентация на тему Получение галогенов. Биологическое значение и применение галогенов
Презентация на тему Получение галогенов. Биологическое значение и применение галогенов  Cложные реакции. Лекция 3
Cложные реакции. Лекция 3 Эмпирические правила
Эмпирические правила Гальванический элемент
Гальванический элемент Синтез латексов
Синтез латексов Салициловая кислота
Салициловая кислота Современные области применения изотопной продукции
Современные области применения изотопной продукции Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Классификация неорганических веществ
Классификация неорганических веществ Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Оксиды углерода
Оксиды углерода Метод молекулярных орбиталей для координационных соединений
Метод молекулярных орбиталей для координационных соединений