Содержание
- 2. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ,
- 3. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 4. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 5. Восстановители - атомы, молекулы или ионы, отдающие электроны. Они в процессе ОВР окисляются Типичные восстановители: ●
- 6. Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются Типичные окислители: ●
- 7. На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем
- 8. Определение степеней окисления атомов химических элементов С.о. атомов х/э в составе простого вущества = 0 Алгебраическая
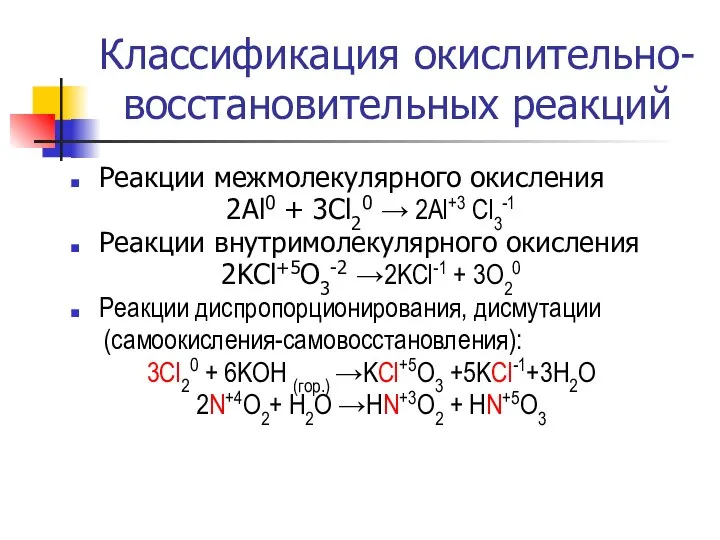
- 9. Классификация окислительно-восстановительных реакций Реакции межмолекулярного окисления 2Al0 + 3Cl20 → 2Al+3 Cl3-1 Реакции внутримолекулярного окисления 2KCl+5O3-2
- 10. Расставьте коэффициенты методом электронного баланса
- 11. Это полезно знать Степени окисления элементов в составе аниона соли такие же, как и в кислоте,
- 13. Скачать презентацию









 Основные понятия и законы химии
Основные понятия и законы химии Влияние качества косметической продукции на здоровье потребителей на примере губной помады
Влияние качества косметической продукции на здоровье потребителей на примере губной помады Теория электролитической диссоциации
Теория электролитической диссоциации Презентация на тему Электролитическая диссоциация
Презентация на тему Электролитическая диссоциация  Поликонденсация. Гомополиконденсациия
Поликонденсация. Гомополиконденсациия Соли. Для учащихся 8 класса
Соли. Для учащихся 8 класса Коллоидные системы
Коллоидные системы Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Проантоцианидины. Антиоксидантные и антирадикальные свойства
Проантоцианидины. Антиоксидантные и антирадикальные свойства Презентация на тему: Изомерия
Презентация на тему: Изомерия Презентация на тему Классификация полимеров
Презентация на тему Классификация полимеров  Растворение. Растворы. Урок в 8 классе
Растворение. Растворы. Урок в 8 классе Металлы. Группы металлов
Металлы. Группы металлов Своя игра. Металлы и неметаллы
Своя игра. Металлы и неметаллы Белки́ (протеины, полипепти́ды)
Белки́ (протеины, полипепти́ды) Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом
Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом Количественный анализ. Титрование
Количественный анализ. Титрование Лабораторная работа №1. Получение гидроксидов цинка и алюминия и исследование их свойств
Лабораторная работа №1. Получение гидроксидов цинка и алюминия и исследование их свойств Классификация белков
Классификация белков Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Дидактическое сопровождение курса Мир органических соединений
Дидактическое сопровождение курса Мир органических соединений Кислоты
Кислоты Тест по теме Спирты. Фенол
Тест по теме Спирты. Фенол Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители Типы кристаллических решеток
Типы кристаллических решеток Чугуны
Чугуны Презентация на тему Амины
Презентация на тему Амины  Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец