Содержание
- 2. Повторим: Сложные вещества Бинарные соединения Бинарные соединения – это соединения, в состав которых входят атомы двух
- 3. НОМЕНКЛАТУРА БИНАРНЫХ СОЕДИНЕНИЙ
- 4. ВНИМАНИЕ! Без нахождения СО дать названия бинарным соединениям, в которых один элемент имеет переменную положительную СО,
- 5. Дать названия бинарным соединениям, в которых ХЭ имеет переменную положительную СО С.О. второго элемента рассчитываем по
- 6. Оксиды – это бинарные соединения, т.е. соединения, состоящие из атомов двух химических элементов, один из которых
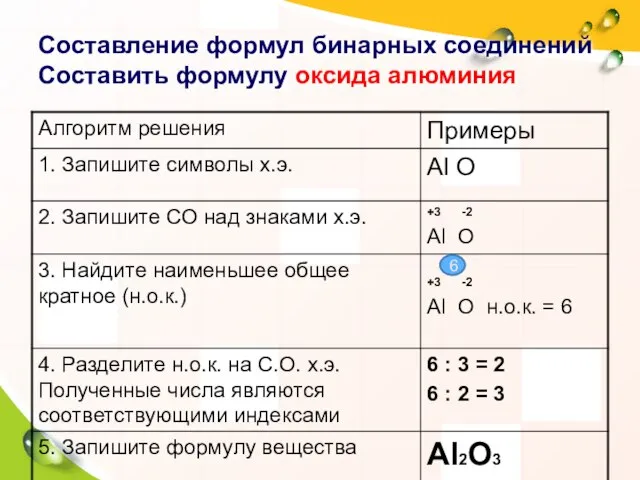
- 7. Составление формул бинарных соединений Составить формулу оксида алюминия 6
- 8. ВНИМАНИЕ! Без нахождения СО химическую формулу мы составить не сможем!
- 9. Повторим: Сложные вещества 2. Кислоты КИСЛОТЫ – это сложные вещества, в составе которых атомы водорода связаны
- 11. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп ОН.
- 13. Алгоритм составления названий оснований Слово «гидроксид» (им.падеж) + название металла (род.падеж) + указание степени окисления, если
- 14. Выберите формулы оснований. Назовите их. НСl, NaOH, Na2O, Ca(OH)2, H2SO4, P2O5, Fe(OH)2, MgO, Cи(OH)2
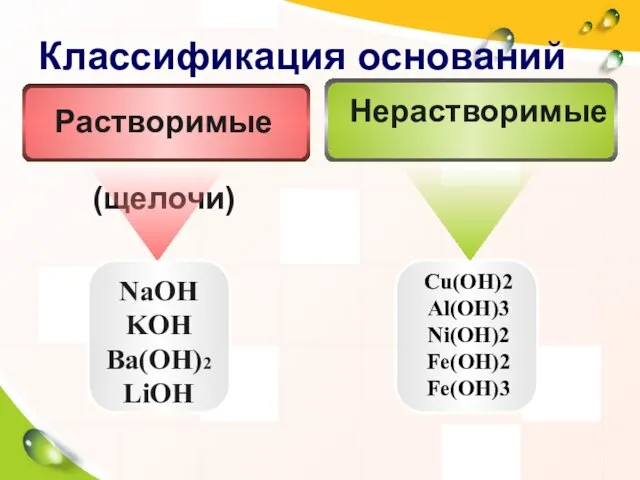
- 15. Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
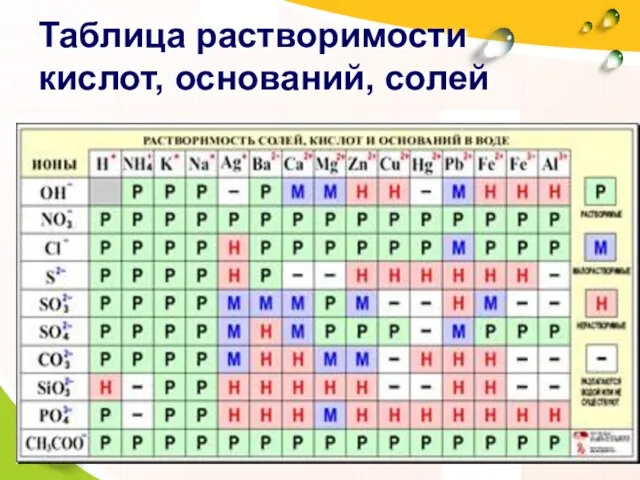
- 16. Таблица растворимости кислот, оснований, солей
- 17. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
- 18. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи
- 22. Скачать презентацию
















 Фенол. Классификация фенолов
Фенол. Классификация фенолов Производство серной кислоты
Производство серной кислоты Общая характеристика металлов
Общая характеристика металлов Новогодний Пробник №190415
Новогодний Пробник №190415 Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Спирты. К кроссворду
Спирты. К кроссворду Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 _ _Производство цветных металлов. Методы плавки алюминия_
_ _Производство цветных металлов. Методы плавки алюминия_ Основные законы химии
Основные законы химии Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Составление химических уравнений
Составление химических уравнений Изомерия. Виды изомерии
Изомерия. Виды изомерии Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Окситоцин. Сила любви и биология
Окситоцин. Сила любви и биология Контрольная работа
Контрольная работа Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Гидроксид кальция – гашеная известь
Гидроксид кальция – гашеная известь Презентация на тему Предельные углеводороды
Презентация на тему Предельные углеводороды  Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой
Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана
Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Русские ученые- химики
Русские ученые- химики Պոլիմերներ
Պոլիմերներ Презентация на тему Движение электрона в атоме
Презентация на тему Движение электрона в атоме  03. Основы номенклатуры
03. Основы номенклатуры