Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
Содержание
- 2. Лекция 13 Уравнения Гиббса-Дюгема-Маргулеса. Обобщенное уравнение Гиббса-Дюгема. Мольные (интегральные) и парциальные мольные величины. Их определение для
- 3. 29-ого октября лекция будет 2-ого ноября лекция будет 5-ого ноября ЛЕКЦИИ не БУДЕТ! 9-ого ноября лекция
- 4. Выберите для каждого химпотенциала (левая колонка) название (правая колонка). Формат ответа: Номер химпот. ; номер названия.
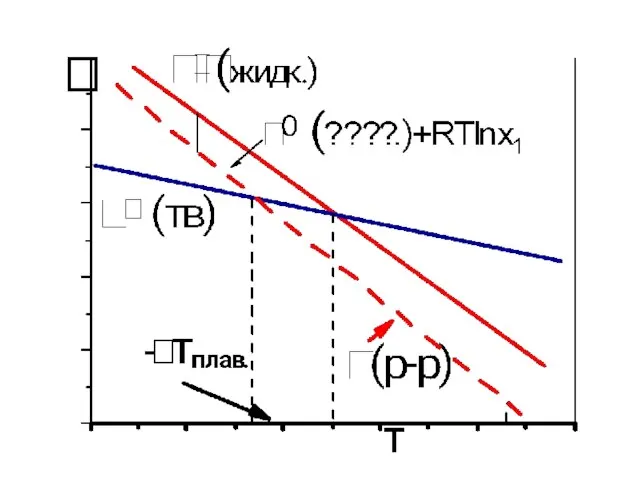
- 5. При добавке примеси температура плавления чистой жидкости всегда понижается 2) Повышение температуры кипения жидкости всегда пропорционально
- 6. Только, если пар идеальный газ!
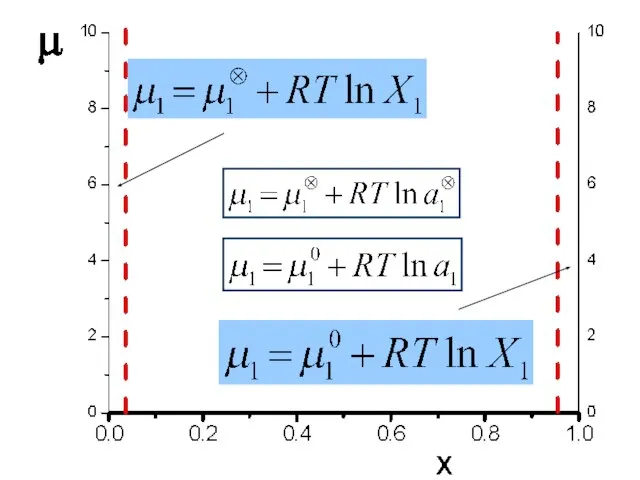
- 8. Активность в растворах – безразмерная величина 2) Активности компонента всегда растет с увеличением мольной доли компонента
- 9. Расслоившейся раствор – это неравновесное состояние 2) Расслаивание раствора - самопроизвольный процесс 3) В азеотропе химические
- 10. Выберите правильные формулы 2 балла 1. 2. 3. 4. 5.
- 11. ХИМИЧЕСКИЕ РАВНОВЕСИЯ в ЖИДКИХ и ТВЕРДЫХ РАСТВОРАХ
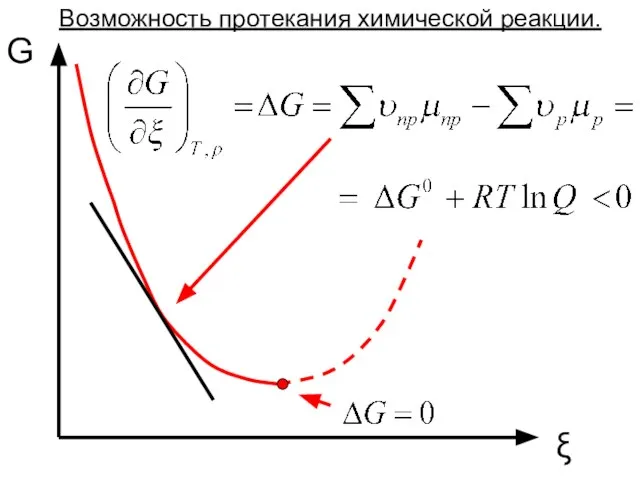
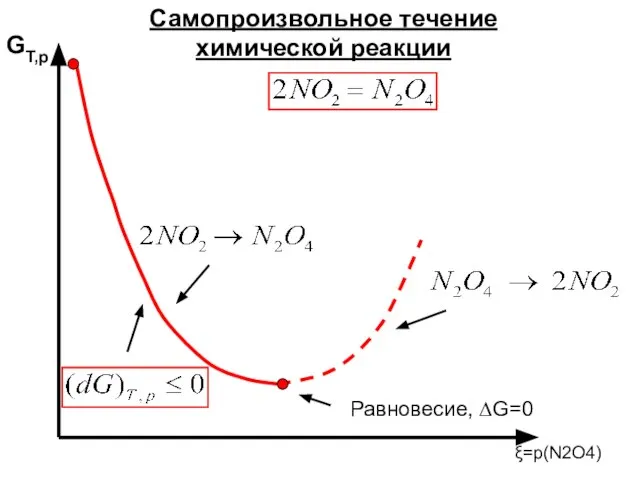
- 12. G ξ Возможность протекания химической реакции.
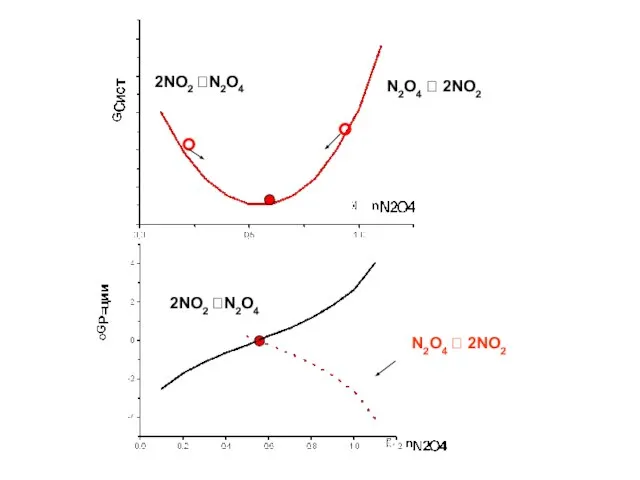
- 13. 2NO2 ?N2O4 N2O4 ? 2NO2 2NO2 ?N2O4 N2O4 ? 2NO2
- 14. Растворитель !
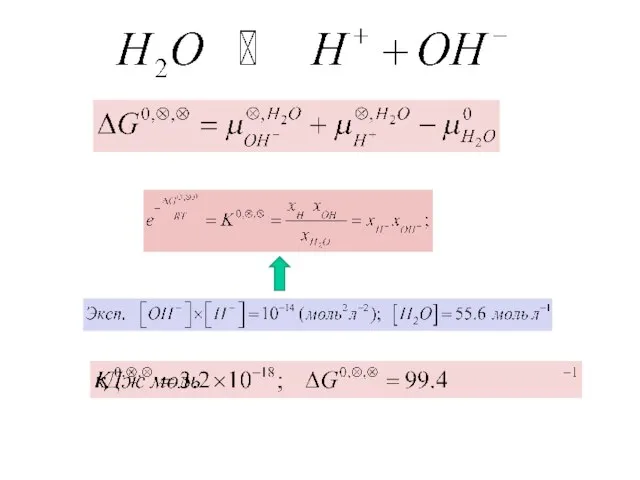
- 16. Электрохимический потенциал.
- 17. ИЗОТЕРМЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- 18. Изотерма химической реакции. Идеальны газы
- 19. Изотерма химической реакции. Реальные газы
- 20. Изотерма химической реакции. Растворы
- 21. CH3COOH + C2H5OH = H2O + CH3COOC2H5 (к) (с) (в) (э) Общий случай
- 22. CH3COOH + C2H5OH = H2O + CH3COOC2H5 (к) (с) (в) (э) Вода - растворитель
- 23. CH3COOH + C2H5OH = H2O + CH3COOC2H5 (к) (с) (в) (э) Спирт - растворитель
- 24. CH3COOH + C2H5OH = H2O + CH3COOC2H5 (к) (с) (в) (э) Инертный растворитель – R (Р)
- 25. Растворитель !
- 27. Ион – молекулярные реакции в одной фазе
- 30. ЗАКОН РАУЛЯ и ЗАКОН ГЕНРИ ЗАКОН ГЕНРИ
- 31. Cвязь между стандартными потенциалами С0 = 1М
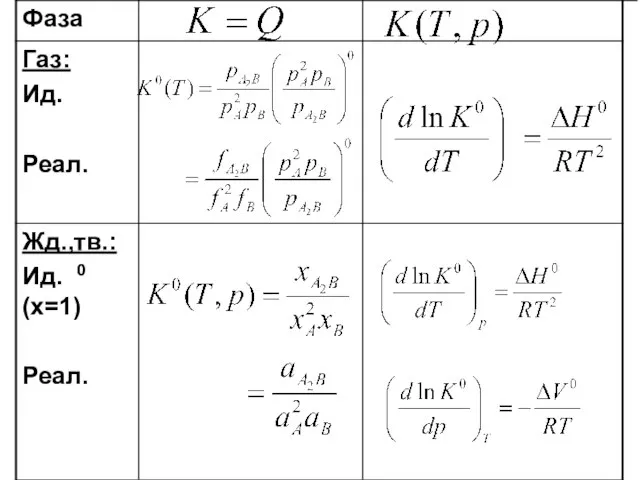
- 32. Практические константы равновесия
- 33. Практические константы равновесия в идеальном газе 2А + В = А2В
- 34. Практические константы равновесия в идеальном газе 2А + В = А2В
- 35. Практические константы равновесия в разбавленном растворе Инертный растворитель!
- 36. Зависимость констант равновесия от давления
- 38. Растворитель !
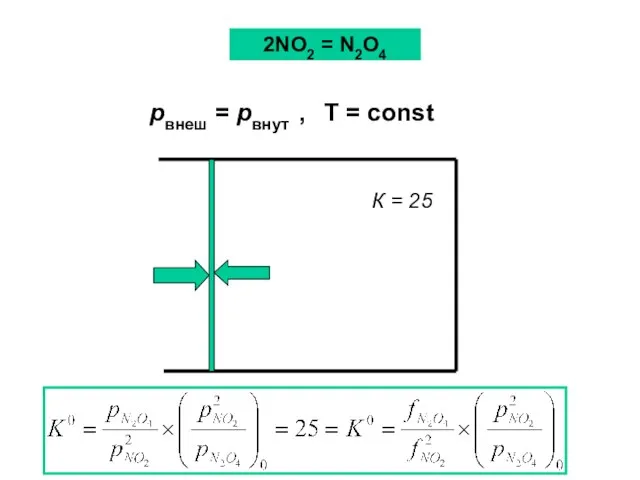
- 41. К = 25 pвнеш = pвнут , T = const 2NO2 = N2O4
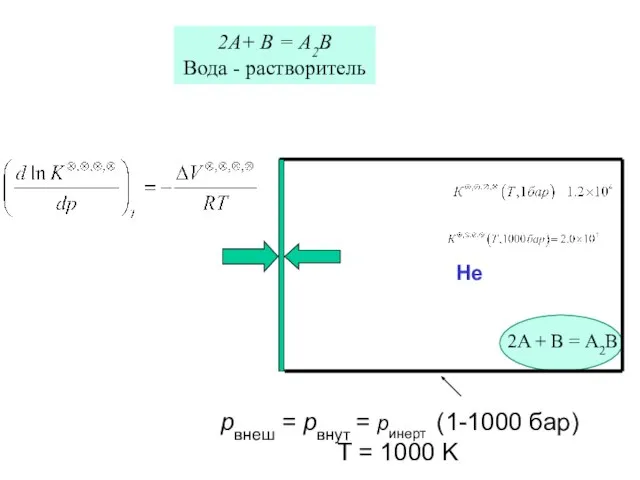
- 42. pвнеш = pвнут = pинерт (1-1000 бар) T = 1000 K Не 2A + B =
- 43. Гетерогенные равновесия. Равновесия с участием чистых жидких и твердых фаз.
- 44. СаO и CaCO3 не смешиваются
- 45. СаO и CaCO3 образуют твердый раствор
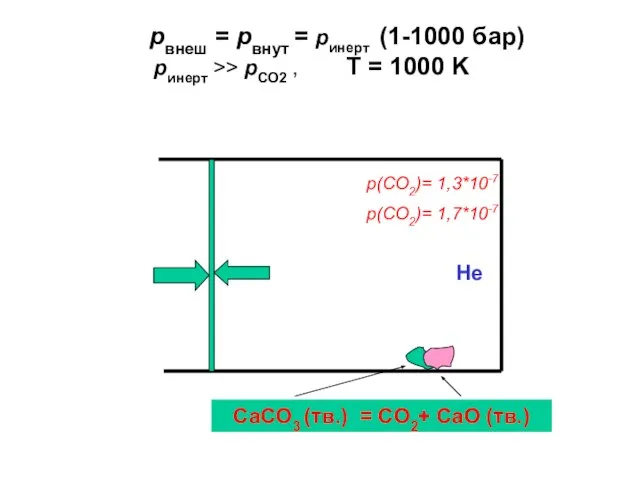
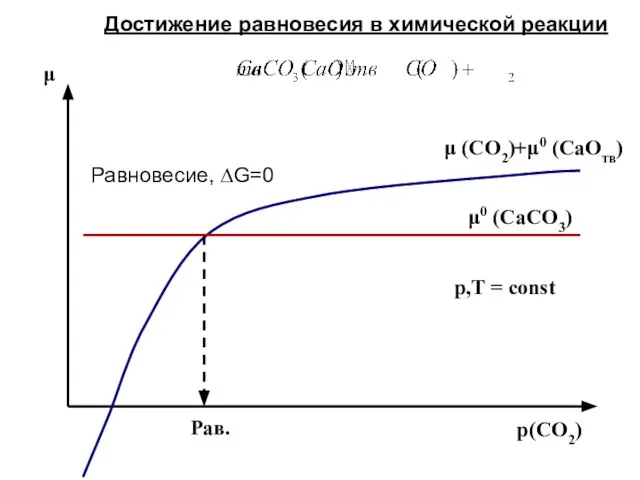
- 46. pвнеш = pвнут = pинерт (1-1000 бар) pинерт >> pCO2 , T = 1000 K p(CO2)=
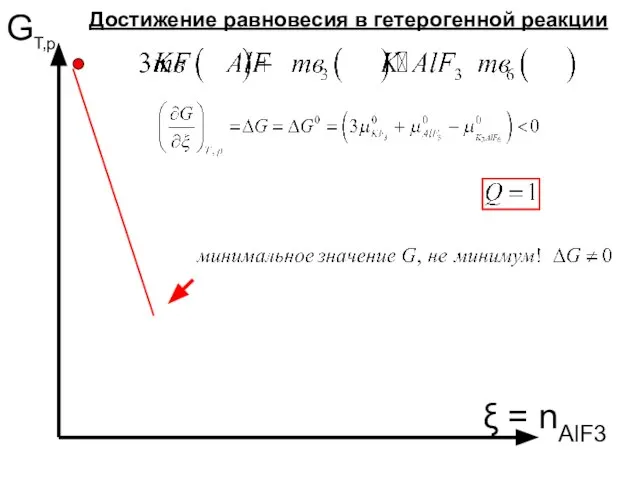
- 47. Гетерогенные равновесия. Минимум или минимальное значение ?
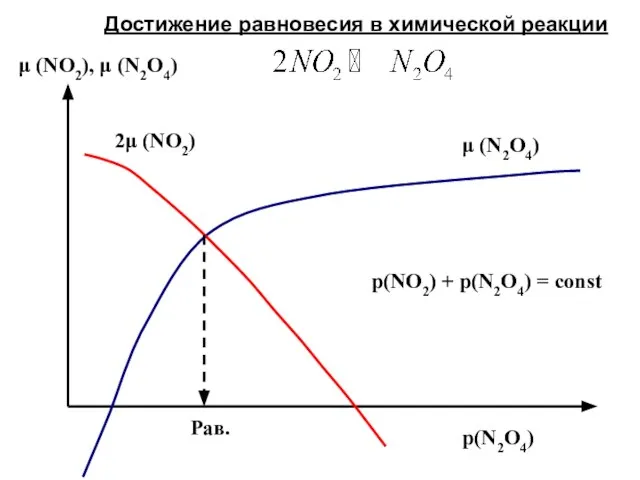
- 48. p(N2O4) μ (NO2), μ (N2O4) Рав. μ (N2O4) 2μ (NO2) p(NO2) + p(N2O4) = const Достижение
- 49. GT,p ξ=p(N2O4) Самопроизвольное течение химической реакции Равновесие, ∆G=0
- 50. n (К3AlF6) μ 3μ (KF)+μ (AlF3) = 3μ0 (KF)+μ0 (AlF3) μ (K3AlF6) = μ0 (K3AlF6) T,
- 51. GТ,р ξ = nAlF3 Достижение равновесия в гетерогенной реакции
- 52. p(CO2) μ Рав. μ (CO2)+μ0 (CaOтв) p,T = const Достижение равновесия в химической реакции μ0 (CaСO3)
- 54. Скачать презентацию




















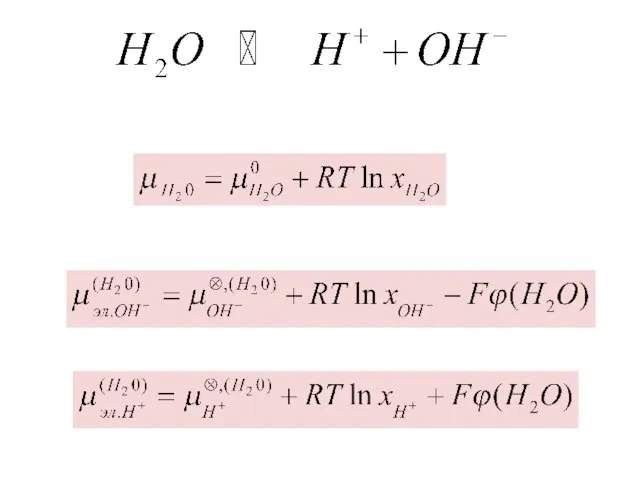

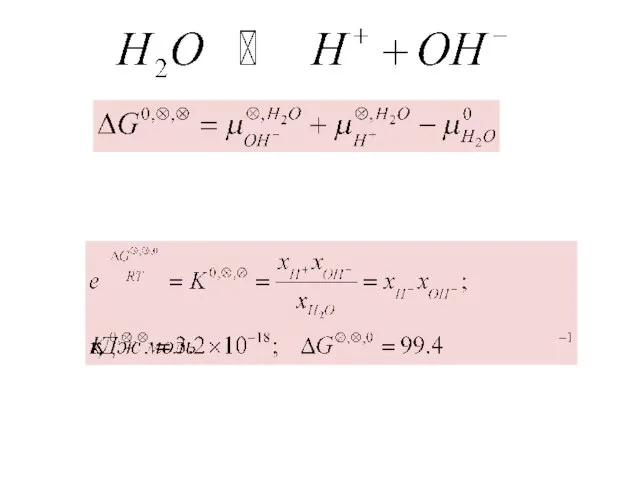















 Галогены
Галогены Химия в быту
Химия в быту Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Презентация на тему Биологические действия радиации
Презентация на тему Биологические действия радиации  Ориентация полимеров
Ориентация полимеров Презентация на тему Техника безопасности для учащихся в кабинете химии
Презентация на тему Техника безопасности для учащихся в кабинете химии  Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия
Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия Валентность химических элементов
Валентность химических элементов Строение и свойства металлов
Строение и свойства металлов Nanofibers of aluminum oxide
Nanofibers of aluminum oxide Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Реакция полимеризации
Реакция полимеризации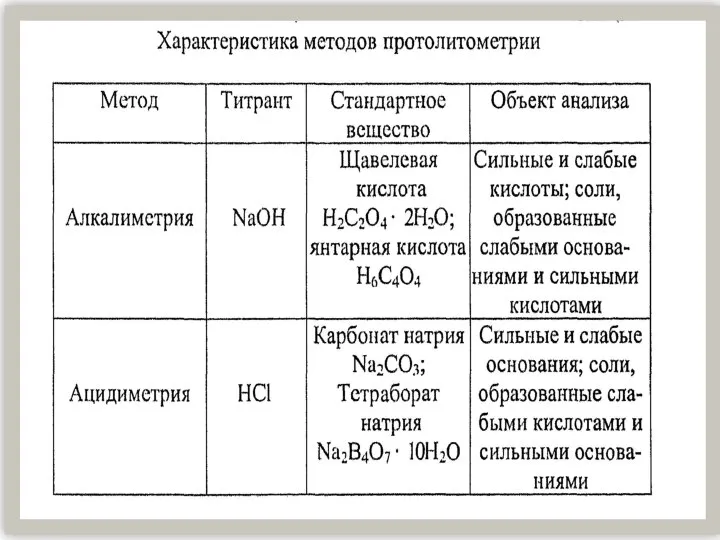 Характеристика методов протолитометрии
Характеристика методов протолитометрии Контроль качества лекарственных средств, производных аминокислот ароматического ряда. Лекция № 11
Контроль качества лекарственных средств, производных аминокислот ароматического ряда. Лекция № 11 Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Химия и сельское хозяйство
Химия и сельское хозяйство Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад
Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад Контроль знаний на уроках химии
Контроль знаний на уроках химии Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Приемы разделения мембранных липидов на классы
Приемы разделения мембранных липидов на классы Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"  Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів Массовая доля элемента в веществе
Массовая доля элемента в веществе Задачи химической кинетики
Задачи химической кинетики Свойства основных липопротеинов (ЛП) плазмы крови
Свойства основных липопротеинов (ЛП) плазмы крови Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии