Слайд 25.Побочные реакции комплексообразования и осаждения

Слайд 3
Пример:
Как будет протекать реакция между двумя окислительно-восстановительными парами Fe3+/Fe2+ и

I2/2I-
в присутствии ЭДТА (Na2H2Y)?
E0Fe3+/Fe2+ = 0,77В; E0I2/2I- = 0,56В
Согласно правилу ( окислительно- восстановительная пара вступает в реакцию своей окисленной формой), в отсутствии ЭДТА, реакция пойдет в следующем направлении:
2 Fe3+ + 2 I- = 2 Fe2+ + I2
Слайд 7Формулы для расчета реального потенциала в случае участия компонентов окислительно-восстановительных пар в

реакциях комплексообразования
В побочных реакциях комплексообразования могут принимать участие как окисленная или восстановленная формы, так и обе формы одновременно.
Слайд 8 Влияние реакций осаждения
Рассмотрим реакцию между двумя окислительно-восстановительными парами Cu2+/Cu+ I2/2I-

E0Cu2+/Cu+ = 0,16 В ; E0I2/2I- = 0,54 В ; Ks(CuI) = 10-12
В соответствии с правилом определения направления окислительно-восстановительной реакции ионы Cu+ должны окисляться I2 :
Сu+ + I2 ≠
Однако реакция идет в противоположном направлении. Связано это с тем, что ионы Cu+ образуют с I- малорастворимое соединение CuI, т.е. в системе присутствует побочная реакция осаждения. Поэтому для оценки окислительно-восстановительных свойств пары Cu2+/Cu+ необходимо рассчитать реальный потенциал этой пары.
Слайд 11Формулы для расчета реальных потенциалов для случая образования малорастворимых соединений компонентами окислительно-восстановительной

пары
Слайд 12Возможность изменения потенциала определенной окислительно- восстановительной пары путем добавления подходящего осадителя или

комплексообразующего реагента или изменения рН позволяет эффективно воздействовать на направление окислительно-восстановительных процессов. Этот способ применяется в аналитической практике для предотвращения нежелательных процессов или для проведения нужных процессов, которые не идут при отсутствии соответствующих реагентов.
Слайд 13Константа химического равновесия окислительно- восстановительных реакций

Слайд 16Если в окислительно- восстановительной системе присутствуют факторы, влияющие на величину потенциала, то

расчет константы химического равновесия нужно проводить через реальные потенциалы.
Пример.
Рассчитать константу равновесия реакции:
MnO4- + 5Fe2+ +8H+ = Mn2+ + 5Fe3+ + 4H2O при рН=3.
E0 MnO4- +8H+/Mn2+ = 1,51 В; E0 Fe3+/Fe2+ = 0,77 B
















 Температура точки росы газа
Температура точки росы газа Изучение основных породообразующих минералов горных пород. Лабораторная работа №1
Изучение основных породообразующих минералов горных пород. Лабораторная работа №1 Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Природные кислоты и щелочи. Индикаторы
Природные кислоты и щелочи. Индикаторы Окислительно-восстановительные реакции. Классификация ОВР
Окислительно-восстановительные реакции. Классификация ОВР хімія
хімія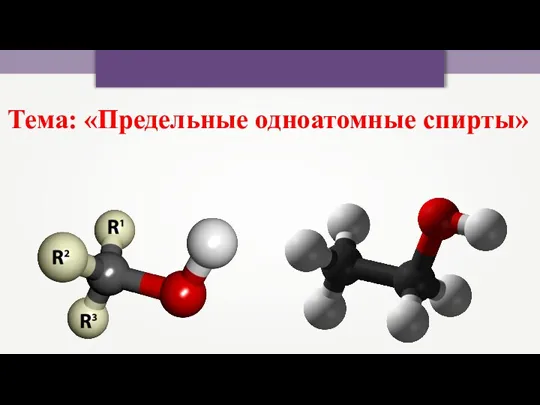 Предельные одноатомные спирты
Предельные одноатомные спирты Основания: номенклатура, классификация, применение, физические свойства
Основания: номенклатура, классификация, применение, физические свойства Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Гидролиз солей
Гидролиз солей Химические свойства оксидов
Химические свойства оксидов Металлы и их соединения
Металлы и их соединения Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Periodická tabuľka prvkov PTP
Periodická tabuľka prvkov PTP Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Кинетика гомогенных реакций
Кинетика гомогенных реакций Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины
Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины Минералы и горные породы
Минералы и горные породы Органические соединения
Органические соединения Типы химических реакций
Типы химических реакций Коррозия металлов и сплавов
Коррозия металлов и сплавов Липиды. Состав липидов
Липиды. Состав липидов Микропластик в окружающей среде
Микропластик в окружающей среде Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды