Слайд 2 Все вещества состоят из молекул.
Молекулы состоят из атомов. Бывает так что атомы

существуют самостоятельно – это атомы элементов VIII группы главной подгруппы ПСХЭ, так называемые благородные газы. Большинство же молекул состоит из двух и более атомов, связанных друг с другом силами электростатического притяжения, вызванных обобществлением электронов и перекрыванием атомных орбиталей.
Слайд 3 В том случае, если молекула состоит из трёх и более атомов

и один из них, располагается в окружении других, то есть образует больше одной химической σ-типа, его атомные орбитали подвергаются гибридизации, тип которой объясняет взаимное расположение атомов в составе молекулы и пространственное строение молекулы:
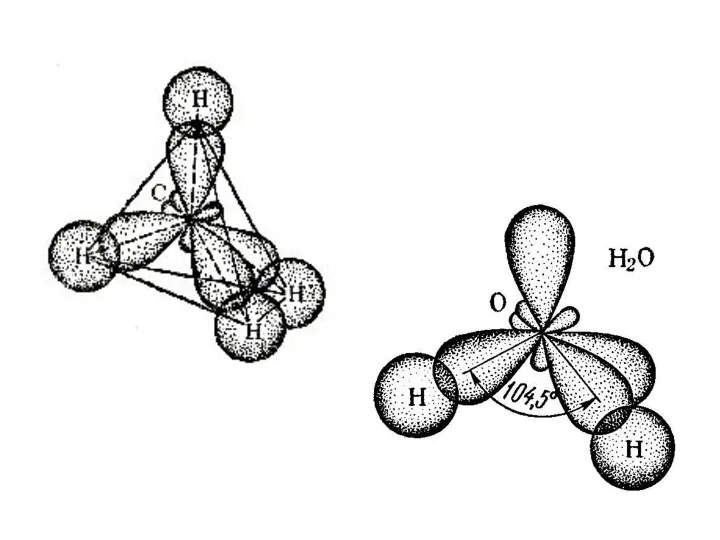
Слайд 4Так если атом связан с четырьмя другими атомами
Тогда орбитали будут направлены к
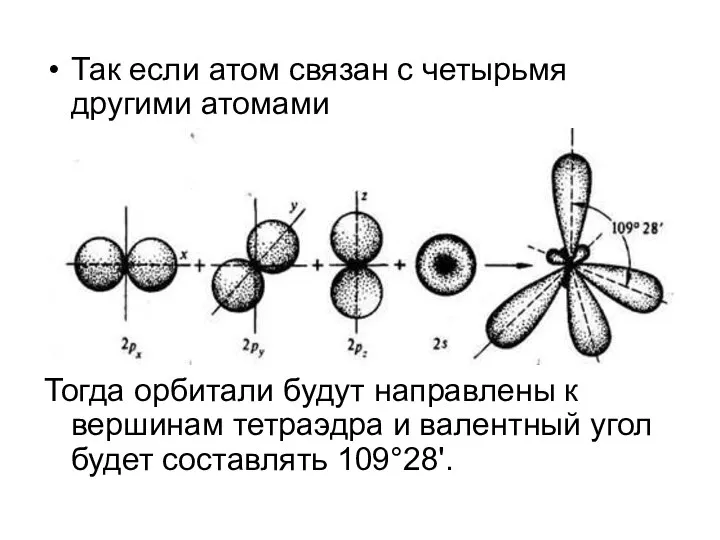
вершинам тетраэдра и валентный угол будет составлять 109°28'.
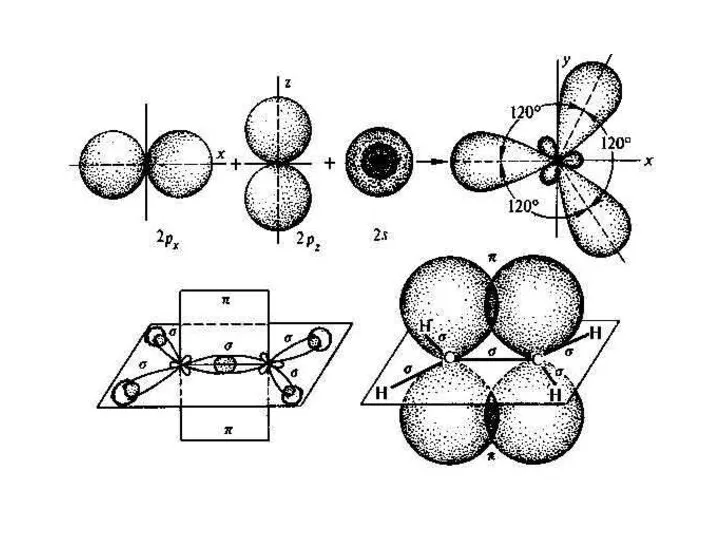
Слайд 6Если же окружение описываемого атома состоит из трёх других атомов:

Слайд 8 sp2-гибридизованный атом и три атома его непосредственного окружения будут расположены в одной

плоскости.
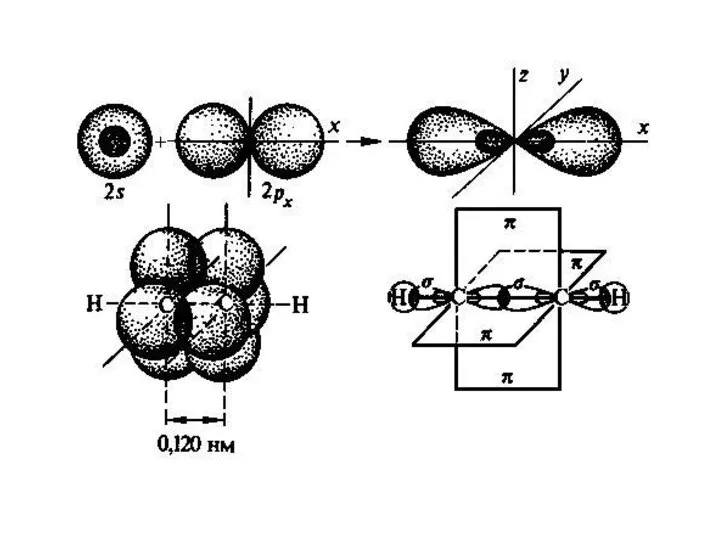
Слайд 9Если же окружение описываемого атома состоит из двух других атомов:

Слайд 11sp-гибридизованный атом и два атома его непосредственного окружения будут расположены на одной

прямой.
Слайд 12 Атомы в молекулах связаны элктростатическими силами взаимодействия, то есть не являются жестко

закреплёнными, и способны поворачиваться «вокруг оси химической связи».
Для оной молекулы возможно несколько пространнственных модификаций.








 Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Тепловой эффект сгорания топлива
Тепловой эффект сгорания топлива Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Неорганические вещества клетки
Неорганические вещества клетки Своя игра. Металлы и неметаллы
Своя игра. Металлы и неметаллы Электролитическая диссоциация
Электролитическая диссоциация Металлы 9 класс
Металлы 9 класс Кислоты. Начальные сведения
Кислоты. Начальные сведения Химические формулы
Химические формулы Презентация на тему Эфирные масла
Презентация на тему Эфирные масла  Алкены
Алкены Скорость химических реакций
Скорость химических реакций Природные кристаллы
Природные кристаллы Свойства воды
Свойства воды Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение знаки химических элементов,относительная атомная масса
знаки химических элементов,относительная атомная масса Химический анализ растворов этилового спирта черной смородины
Химический анализ растворов этилового спирта черной смородины Техника безопасности (3)
Техника безопасности (3) Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Самородные минералы
Самородные минералы Степень окисления
Степень окисления Алмаз, бриллиант
Алмаз, бриллиант Самостоятельная работа
Самостоятельная работа Химическае препараты
Химическае препараты Адсорбционно-десорбционные взаимодействия фосфатов кальция и аминокислот
Адсорбционно-десорбционные взаимодействия фосфатов кальция и аминокислот Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений