Содержание
- 2. Тита́н — химический элемент с атомным номером 22[4]. Принадлежит к 4-й группепериодической таблицы химических элементов (по
- 3. История титана Открытие TiO2 (диоксида титана) сделали практически одновременно и независимо друг от друга англичанин У.
- 4. Физические свойства Титан — лёгкий серебристо-белый металл. При нормальном давлении существует в двух кристаллических модификациях: низкотемпературный
- 5. Химические свойства Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в
- 6. Применение Использование металлического титана во многих отраслях промышленности обусловлено тем, что его прочность примерно равна прочности
- 7. Марки титанов и сплавов Наиболее распространенными марками титана являются ВТ1-0, ВТ1-00, ВТ1-00св. Титан указанных марок называется
- 8. Достоинства/Недостатки Достоинства:малая плотность (4500 кг/м3) способствует уменьшению массы выпускаемых изделий; высокая механическая прочность. Стоит отметить, что
- 9. Применение Основная часть титана расходуется на нужды авиационной и ракетной техники и морского судостроения. Его, а
- 11. Скачать презентацию
Слайд 2Тита́н — химический элемент с атомным номером 22[4]. Принадлежит к 4-й группепериодической таблицы химических элементов (по устаревшей короткой форме периодической
Тита́н — химический элемент с атомным номером 22[4]. Принадлежит к 4-й группепериодической таблицы химических элементов (по устаревшей короткой форме периодической
![Тита́н — химический элемент с атомным номером 22[4]. Принадлежит к 4-й группепериодической](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/913374/slide-1.jpg)
Слайд 3История титана
Открытие TiO2 (диоксида титана) сделали практически одновременно и независимо друг от друга
История титана
Открытие TiO2 (диоксида титана) сделали практически одновременно и независимо друг от друга

Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Титан не находил промышленного применения, пока Г. Кролл (англ.)русск. в 1940 году не запатентовал простой магниетермический метод восстановления металлического титана из тетрахлорида; этот метод (процесс Кролла (англ.)русск.) до настоящего времени остаётся одним из основных в промышленном получении титана.
Слайд 4Физические свойства
Титан — лёгкий серебристо-белый металл. При нормальном давлении существует в двух кристаллических модификациях:
Физические свойства
Титан — лёгкий серебристо-белый металл. При нормальном давлении существует в двух кристаллических модификациях:

Температура плавления титана при нормальном давлении равна 1670 ± 2 °C, или 1943 ± 2 К (принята в качестве одной из вторичных калибровочных точек температурной шкалы ITS-90 (англ.)русск.)[2]. Температура кипения 3287 °C[2]. При достаточно низкой температуре (-80°C)[2] , титан становится довольно хрупким. Молярная теплоёмкость при нормальных условиях Cp = 25,060 кДж/(моль·K), что соответствует удельной теплоёмкости 0,523 кДж/(кг·K)[2]. Теплота плавления 15 кДж/моль[11], теплота испарения 410 кДж/моль[11]. Характеристическая дебаевская температура 430 К[11]. Теплопроводность 21,9 Вт/(м·К) при 20 °C[11]. Температурный коэффициент линейного расширения 9,2·10−6 К−1 в интервале от −120 до +860 °C[11]. Молярная энтропия α-титана S0 = 30,7 кДж/(моль·К)[2]. Для титана в газовой фазе энтальпия формирования ΔH0 f = 473,0 кДж/моль, энергия Гиббса ΔG0 f = 428,4 кДж/моль, молярная энтропия S0 = 180,3 кДж/(моль·К), теплоёмкость при постоянном давлении Cp = 24,4 кДж/(моль·K)[2]
Удельное электрическое сопротивление при 20 °C составляет 0,58 мкОм·м[11] (по другим данным 0,42 мкОм·м[3]), при 800 °C 1,80 мкОм·м[3]. Температурный коэффициент сопротивления 0,003 К−1 в диапазоне 0…20 °C[11].
Пластичен, сваривается в инертной атмосфере. Прочностные характеристики мало зависят от температуры, однако сильно зависят от чистоты и предварительной обработки[3]. Для технического титана твёрдость по Виккерсу составляет 790—800 МПа, модуль нормальной упругости 103 ГПа, модуль сдвига 39,2 ГПа[11]. У высокочистого предварительно отожжённого в вакууме титана предел текучести 140—170 МПа, относительное удлинение 55—70%, твёрдость по Бринеллю716 МПа[3].
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Температура перехода в сверхпроводящее состояние 0,387 К. При температурах выше 73 кельвин титан парамагнитен. Магнитная восприимчивость при 20 °C составляет 3,2·10−6[3]. Постоянная Холла α-титана равна +1,82·10−13[3].
Слайд 5Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также

Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4). Титан устойчив к влажному хлору и водным растворам хлора[2].
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−. Титан наиболее подвержен коррозии в органических средах, так как в присутствии воды на поверхности титанового изделия образуется плотная пассивная пленка из оксидов и гидрида титана. Наиболее заметное повышение коррозионной стойкости титана заметно при повышении содержания воды в агрессивной среде с 0,5 до 8,0 %, что подтверждается электрохимическими исследованиями электродных потенциалов титана в растворах кислот и щелочей в смешанных водно-органических средах[14].
При нагревании на воздухе до 1200 °C Ti загорается ярким белым пламенем с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
{\displaystyle {\mathsf {TiO_{2}+K_{2}CO_{3}\rightarrow K_{2}TiO_{3}+CO_{2}}}}При нагревании Ti взаимодействует с галогенами (например, с хлором — при 550 °C[2]). Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4, содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4 водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С азотом N2 выше 400 °C титан образует нитрид TixNx = (Ti25N13 - TiN). Титан — единственный элемент, который горит в атмосфере азота[2].
При взаимодействии титана с углеродом образуется карбид титана TixCx(x = Ti20C9 - TiC.
При нагревании Ti поглощает H2 с образованием соединения переменного состава TixHx(x = Ti10H13 - TiH2. При нагревании эти гидриды разлагаются с выделением H2.
Титан образует сплавы и интерметаллические соединения со многими металлами.
Слайд 6Применение
Использование металлического титана во многих отраслях промышленности обусловлено тем, что его
Применение
Использование металлического титана во многих отраслях промышленности обусловлено тем, что его

Титан в виде сплавов является важнейшим конструкционным материалом в авиа- и ракетостроении, в кораблестроении.
Металл применяется в химической промышленности (реакторы, трубопроводы, насосы, трубопроводная арматура), военной промышленности (бронежилеты, броня и противопожарные перегородки в авиации, корпуса подводных лодок), промышленных процессах (опреснительных установках, процессах целлюлозы и бумаги), автомобильной промышленности, сельскохозяйственной промышленности, пищевой промышленности, спортивных товарах, ювелирных изделиях, мобильных телефонах, лёгких сплавах и т. д.
Титан является физиологически инертным[2], благодаря чему применяется в медицине (протезы, остеопротезы, зубные имплантаты), в стоматологических и эндодонтических инструментах, украшениях для пирсинга.
Титановое литьё выполняют в вакуумных печах в графитовые формы. Также используется вакуумное литьё по выплавляемым моделям. Из-за технологических трудностей в художественном литье используется ограниченно. Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на площади его имени в Москве[15].
Титан является легирующей добавкой во многих легированных сталях и большинстве спецсплавов[каких?].
Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.
Алюминиды титана являются очень стойкими к окислению и жаропрочными, что, в свою очередь, определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
Титан является одним из наиболее распространённых геттерных материалов, используемых в высоковакуумных насосах.
Существует множество титановых сплавов с различными металлами. Легирующие элементы разделяют на три группы, в зависимости от их влияния на температуру полиморфного превращения: на бета-стабилизаторы, альфа-стабилизаторы и нейтральные упрочнители. Первые понижают температуру превращения, вторые повышают, третьи не влияют на неё, но приводят к растворному упрочнению матрицы. Примеры альфа-стабилизаторов: алюминий, кислород, углерод, азот. Бета-стабилизаторы: молибден, ванадий, железо, хром, никель. Нейтральные упрочнители: цирконий, олово, кремний. Бета-стабилизаторы, в свою очередь, делятся на бета-изоморфные и бета-эвтектоидообразующие.
Самым распространённым титановым сплавом является сплав Ti-6Al-4V (англ.)русск. (в российской классификации — ВТ6), содержащий около 6% алюминия и около 4% ванадия. По соотношению кристаллических фаз он классифицируется как (α+β)-сплав. На его производство идёт до 50% добываемого титана[3].
Ферротитан (сплав титана с железом, содержащий 18—25% титана) используют в чёрной металлургии для раскисления стали и удаления растворённых в ней нежелательных примесей (сера, азот, кислород)[3].
В 1980-х годах около 60-65 % добываемого в мире титана использовалось в строительстве летательных аппаратов и ракет, 15% — в химическом машиностроении, 10% — в энергетике, 8% — в строительстве судов и для опреснителей воды[3].
Слайд 7Марки титанов и сплавов
Наиболее распространенными марками титана являются ВТ1-0, ВТ1-00, ВТ1-00св. Титан
Марки титанов и сплавов
Наиболее распространенными марками титана являются ВТ1-0, ВТ1-00, ВТ1-00св. Титан

Слайд 8Достоинства/Недостатки
Достоинства:малая плотность (4500 кг/м3) способствует уменьшению массы выпускаемых изделий;
высокая механическая прочность. Стоит
Достоинства/Недостатки
Достоинства:малая плотность (4500 кг/м3) способствует уменьшению массы выпускаемых изделий;
высокая механическая прочность. Стоит

необычайно высокая коррозионная стойкость, обусловленная способностью Ti образовывать на поверхности тонкие (5-15 мкм) сплошные пленки оксида ТiO2, прочно связанные с массой металла;
удельная прочность (отношение прочности и плотности) лучших титановых сплавов достигает 30-35 и более, что почти вдвое превышает удельную прочность легированных сталей.
Недостатки:высокая стоимость производства, Ti значительно дороже железа, алюминия, меди, магния;
активное взаимодействие при высоких температурах, особенно в жидком состоянии, со всеми газами, составляющими атмосферу, в результате чего Ti и его сплавы можно плавить лишь в вакууме или в среде инертных газов;
трудности вовлечения в производство титановых отходов;
плохие антифрикционные свойства, обусловленные налипанием Ti на многие материалы; титан в паре с титаном вообще не может работать на трение;
высокая склонность Ti и многих его сплавов к водородной хрупкости и солевой коррозии;
плохая обрабатываемость резанием, аналогичная обрабатываемости нержавеющих сталей аустенитного класса;
большая химическая активность, склонность к росту зерна при высокой температуре и фазовые превращения при сварочном цикле вызывают трудности при сварке титана.
Слайд 9Применение
Основная часть титана расходуется на нужды авиационной и ракетной техники и морского
Применение
Основная часть титана расходуется на нужды авиационной и ракетной техники и морского

 Фосфор в организме человека
Фосфор в организме человека Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Распределение электронов в атомах
Распределение электронов в атомах История органической химии. Урок химии в 10 классе
История органической химии. Урок химии в 10 классе Алканы
Алканы Решение 33 задания
Решение 33 задания h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin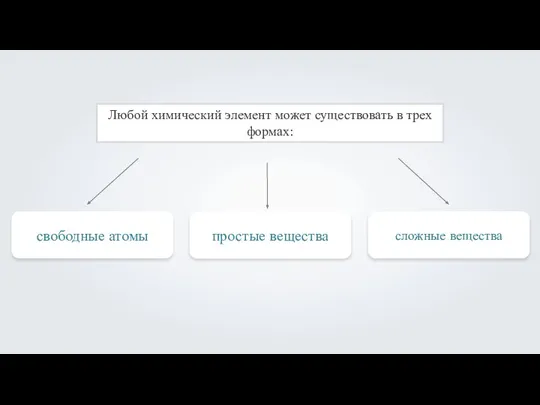 Строение атома
Строение атома Соли
Соли Презентация на тему Химия в косметике
Презентация на тему Химия в косметике  Реакционная способность углеводородов. Реакции SR, АЕ , SЕ
Реакционная способность углеводородов. Реакции SR, АЕ , SЕ Лайфхаки на кухне
Лайфхаки на кухне Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Тренинг по теме Валентность
Тренинг по теме Валентность Окислительно - восстановительные свойства серной кислоты
Окислительно - восстановительные свойства серной кислоты Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Основные классы неорганических соединений
Основные классы неорганических соединений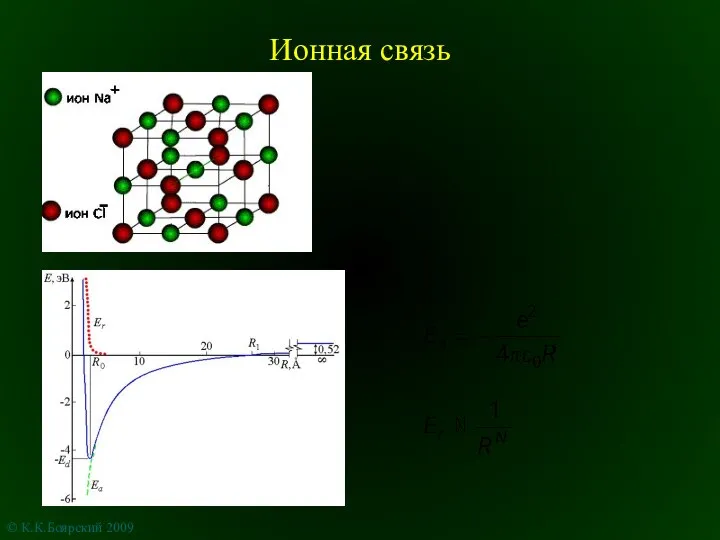 Ионная связь
Ионная связь Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Аргон
Аргон Презентация на тему Способы получения металлов
Презентация на тему Способы получения металлов  Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды)
Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды) Термохимические эффекты реакций
Термохимические эффекты реакций Классы неорганических веществ
Классы неорганических веществ