Содержание
- 2. Повторение изученного ранее Что такое атом? Что такое ион? Чем отличается ион от атома? Какие типы
- 3. Правила вычисления степени окисления (СО) элементов:
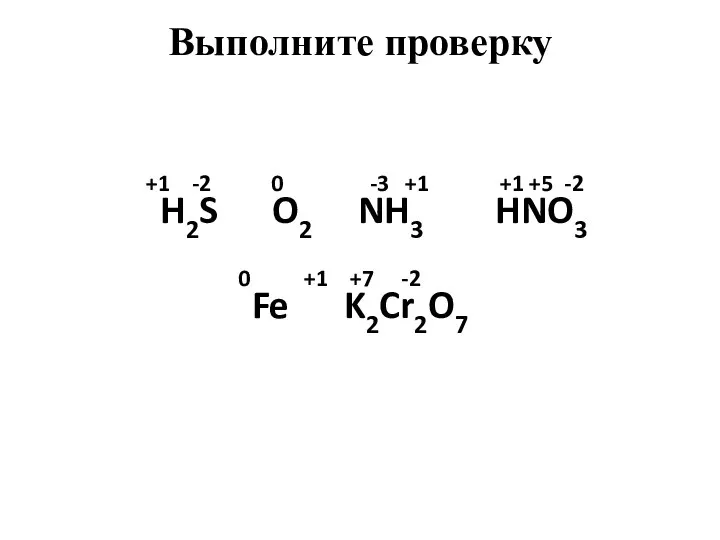
- 4. Определите степени окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
- 5. +1 -2 0 -3 +1 +1 +5 -2 H2S O2 NH3 HNO3 0 +1 +7 -2
- 6. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
- 7. « Кто-то теряет, а кто-то находит.» Тема урока: «Окислительно-восстановительные реакции»
- 8. Цель урока: отработать умение записывать процессы изменения степеней окисления частиц с целью определения коэффициентов, необходимых для
- 9. План Повторение домашнего задания Актуализация знаний Изучение нового материала Закрепление Рефлексия Домашнее задание
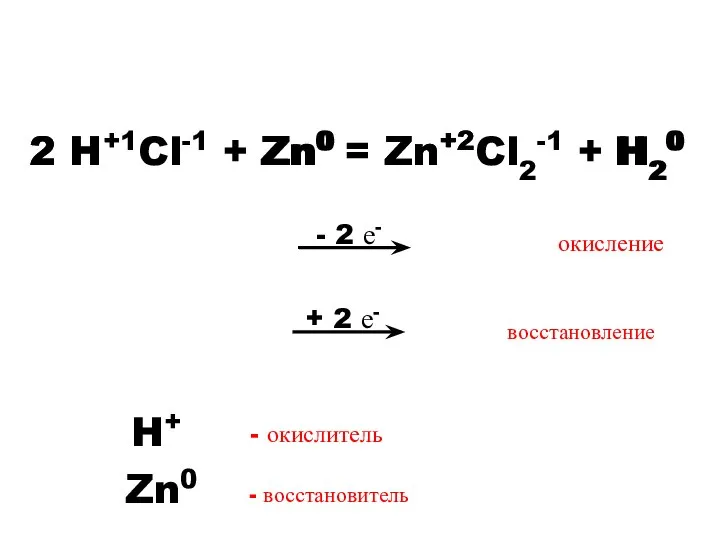
- 10. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 11. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
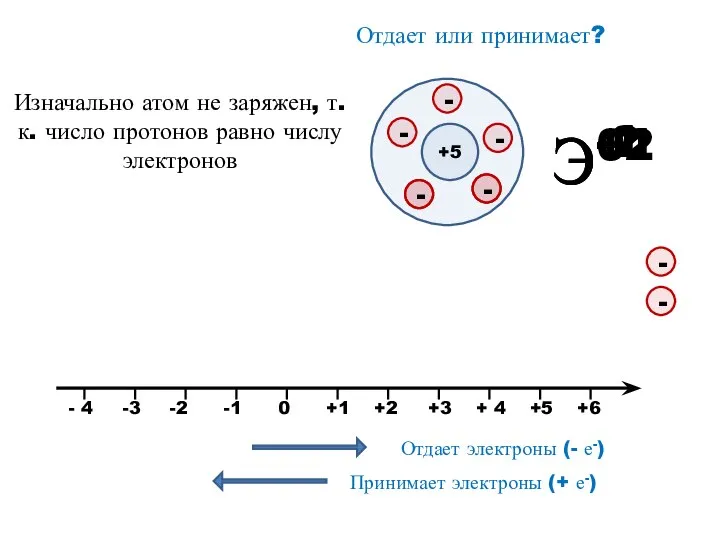
- 12. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
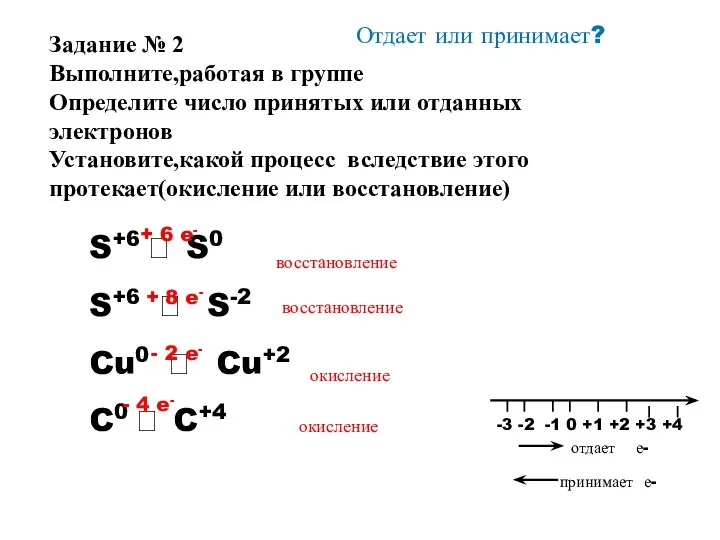
- 13. Отдает или принимает? S+6 ? S0 S+6 ? S-2 Cu0 ? Cu+2 C0 ? C+4 +
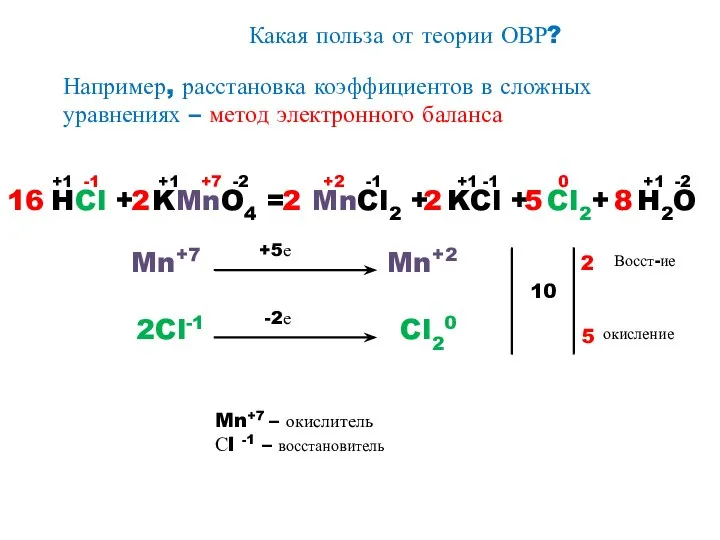
- 14. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 15. План составления уравнений ОВР и электронного баланса к ним 1. Записать схему реакции. 2. Определить, атомы
- 16. Физкультминутка
- 17. Вспомним правила техники безопасности При работе с кислотами необходимо помнить, что эти вещества опасны Оборудование должно
- 18. Опыт №2 Нитрат серебра + Медь= AgNO3 + Cu → Cu(NO3)2 + Ag↓ Опыт №1 Карбонат
- 19. AgNO3 + Cu → Cu(NO3)2 + Ag↓ Ag+1 +1 e Ag0 Cu0 - 2 e Cu+2
- 20. ОВР в быту
- 21. Выяснить, как окислительно-восстановительные реакции применяются в быту. Цель работы:
- 22. Газ метан горит бесцветным пламенем с образованием воды и углекислого газа СН4+2О2=СО2+2Н2О Горение газа на кухне
- 23. При обработке персолью отбеливание происходит за счет окисления загрязнений 2H2O2=2H2O+O2. Для того чтобы образующийся кислород не
- 24. При взаимодействии железа и кислорода образуется ржавчина. 4Fe+ 2O2= 2Fe2O3 Коррозия металла
- 25. Мы часто сталкиваемся с окислительно-восстановительными реакциями в быту: при горении газа; при коррозии металлов; при отбеливании
- 26. Задание №3 Выполните, работая в группе 1. Из приведенных схем уравнений реакций выпишите те, которые можно
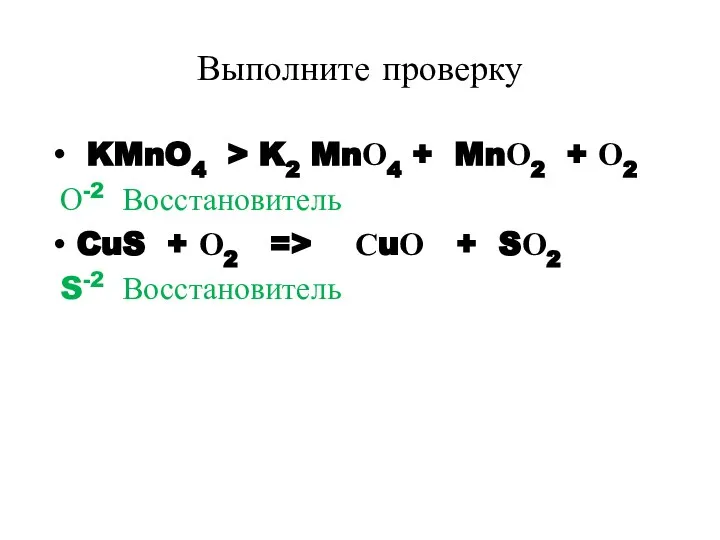
- 27. Выполните проверку KMnO4 > K2 MnО4 + MnО2 + О2 О-2 Восстановитель CuS + О2 =>
- 31. Скачать презентацию






















 Презентация на тему Применение этанола и влияние его на человека
Презентация на тему Применение этанола и влияние его на человека  Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация органических веществ
Классификация органических веществ Л1.3. Фазы в металлических сплавах
Л1.3. Фазы в металлических сплавах Пименов_Химический состав
Пименов_Химический состав Карбоциклические соединения. Циклоалканы
Карбоциклические соединения. Циклоалканы Химия и производство
Химия и производство Азотная кислота
Азотная кислота Алкены. Строение, номенклатура, изомерия, физические свойства
Алкены. Строение, номенклатура, изомерия, физические свойства Алюминий и его органические производные
Алюминий и его органические производные Типы химических связей
Типы химических связей Некоторые понятия общей химии в виртуальных моделях
Некоторые понятия общей химии в виртуальных моделях Валентность
Валентность Белки
Белки Минералы
Минералы Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Минералы
Минералы Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Интрузивные контакты. Контакты интрузивных и осадочных пород
Интрузивные контакты. Контакты интрузивных и осадочных пород Свойства бензола
Свойства бензола Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад
Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад Химические реакции
Химические реакции 11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс
11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс