Содержание
- 2. Тема исследования: Скорость химической реакции и её зависимость от условий протекания.
- 3. Понятие скорости (в физике) Скорость- это отношение пройденного пути в единицу времени. V= S/t
- 4. Скорость реакции определяется изменением количества вещества в единицу времени или изменением молярной концентрации вещества за единицу
- 5. Понятие о скорости химической реакции Скорость реакции определяется изменением концентрации одного из реагирующих веществ или одного
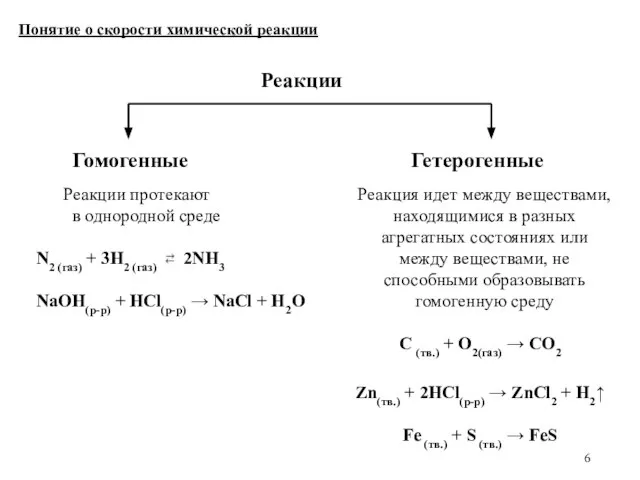
- 6. Понятие о скорости химической реакции Реакции Гомогенные Реакции протекают в однородной среде N2 (газ) + 3H2
- 7. Скорость гетерогенной реакции (υгетер.) определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ
- 8. Факторы, влияющие на скорость: 1.Природа реагирующих веществ HCl Mg Zn
- 9. Факторы, влияющие на скорость 2.Концентрация реагирующих веществ. Zn+CuSO4 (конц) Zn+CuSO4 (разб)
- 10. Концентрация: С повышением концентрации реагирующих веществ увеличивается скорость реакции. Факторы, влияющие на скорость химической реакции Закон
- 11. Для реакции mA + nB = C по закону действующих масс: υ = k ∙ СAm
- 12. Задача 1. Реакция идет по уравнению А +2В → С. Во сколько раз и как изменится
- 13. Факторы, влияющие на скорость 3. Поверхность соприкосновения реагирующих веществ HCl CaCO3 (кусочек) CaCO3 (порошок)
- 14. Факторы, влияющие на скорость Температура H2SO4 H2SO4 + CuO H2SO4 + CuO
- 15. Факторы, влияющие на скорость химической реакции 3. Температура: при повышении температуры на каждые 100 С, скорость
- 16. Дано: υt1 = 1 моль/л ∙ ч γ =3 t1 = 00С t2 = 300С Найти:
- 17. Факторы, влияющие на скорость 5. Наличие катализатора. MnO2 H2O2 H2O2
- 18. 4. Катализаторы – вещества, ускоряющие химические реакции. А + В → С – протекает медленно А
- 19. Скорость химической реакции- это величина, показывающая изменение молярной концентрации в единицу времени. Факторы, влияющие на скорость:
- 20. Мой кластер Скорость реакции
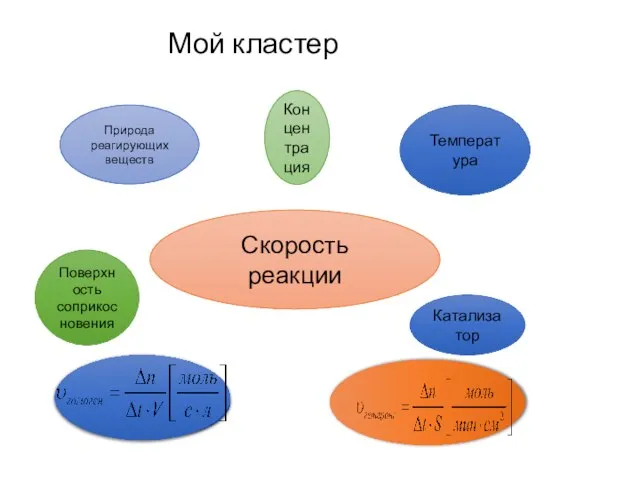
- 21. Мой кластер Скорость реакции Концентрация Природа реагирующих веществ Поверхность соприкосновения Катализатор Температура
- 23. Скачать презентацию

















 Замедленное коксование гудрона
Замедленное коксование гудрона Органическая химия
Органическая химия Соль - без вины виновата
Соль - без вины виновата Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Электролитическая диссоциация
Электролитическая диссоциация Ko pēta ķīmija
Ko pēta ķīmija Химики на службе у дорог
Химики на службе у дорог Метанол. Краткая характеристика
Метанол. Краткая характеристика Презентация на тему Электролиз расплавов и растворов
Презентация на тему Электролиз расплавов и растворов  Кислоты органические и неорганически
Кислоты органические и неорганически Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Тестовые задания. Атомы
Тестовые задания. Атомы Турнир знатоков химии
Турнир знатоков химии Игра Что? Где? Когда?. Химия
Игра Что? Где? Когда?. Химия Пероксид щелочных металлов
Пероксид щелочных металлов Актуальные вопросы биохимии спорта. Лекция 2
Актуальные вопросы биохимии спорта. Лекция 2 Алканы – строение, химические свойства
Алканы – строение, химические свойства Полупроводники. Химические свойства полупроводников
Полупроводники. Химические свойства полупроводников Атомның электрондық құрылысы
Атомның электрондық құрылысы Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Реакции неполного окисления в органике
Реакции неполного окисления в органике Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Реакции разложения
Реакции разложения Алкины
Алкины Алкины. Понятие об алкинах
Алкины. Понятие об алкинах