Содержание
- 2. Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав
- 3. Катионы (+) → катод (-) Анионы (-) → Анод (+)
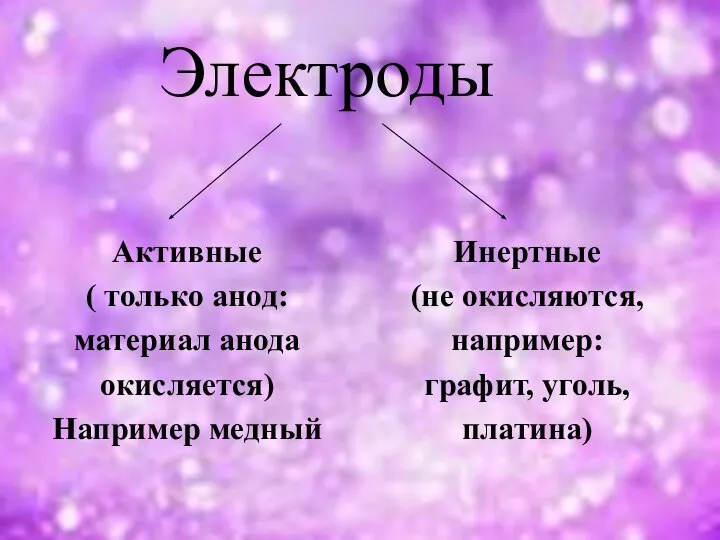
- 4. Электроды
- 5. 2 вида электролиза: - электролиз расплавов - электролиз растворов
- 6. Электролиз расплава Хлорида натрия NaCl → Na + + Cl – K (-)Na ++ ẽ →Na
- 7. Электролиз растворов электролитов
- 8. Правила восстановления катионов на катоде:
- 9. Правила восстановления анионов на аноде: a) если анод не растворимый Cl-, Br-, S-, I -… Бескислородные
- 10. SO4 2- ; NO3- ; PO 43- ; СO32- (кислородсодержащие анионы – не окисляются, окисляется вода.)
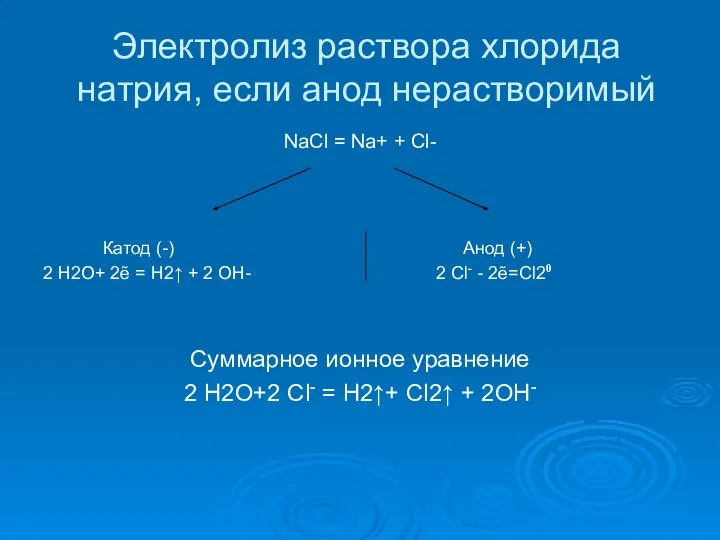
- 11. Электролиз раствора хлорида натрия, если анод нерастворимый NaCl = Na+ + Cl- Катод (-) Анод (+)
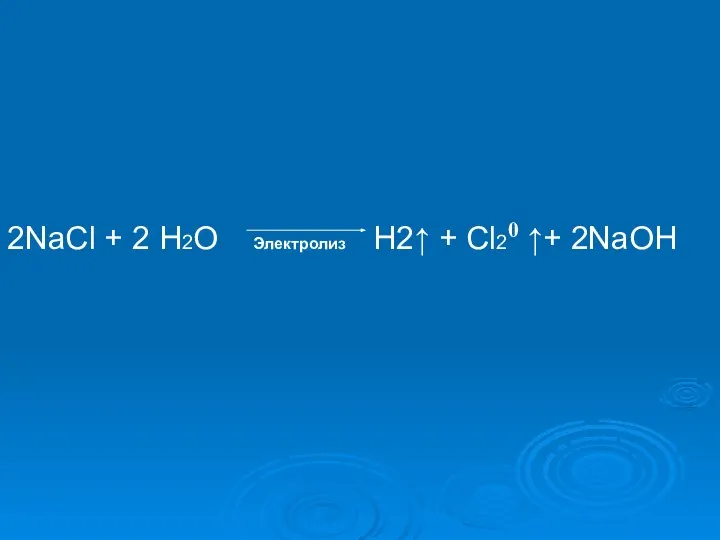
- 12. 2NaCl + 2 Н2О Электролиз Н2↑ + Cl20 ↑+ 2NaOH
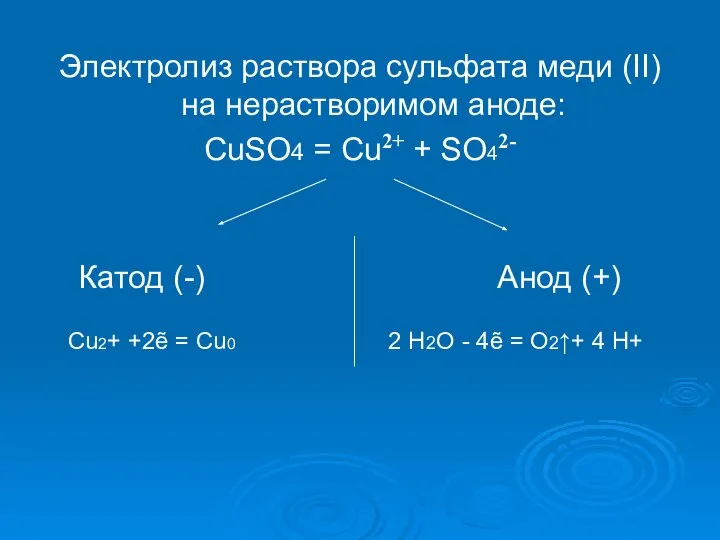
- 13. Электролиз раствора сульфата меди (II) на нерастворимом аноде: CuSO4 = Cu2+ + SO42- Катод (-) Анод
- 14. Cu2+ +2ẽ = Cu0 2 2 Н2О - 4ẽ = O2↑+ 4 H+ 1 Суммарное ионное
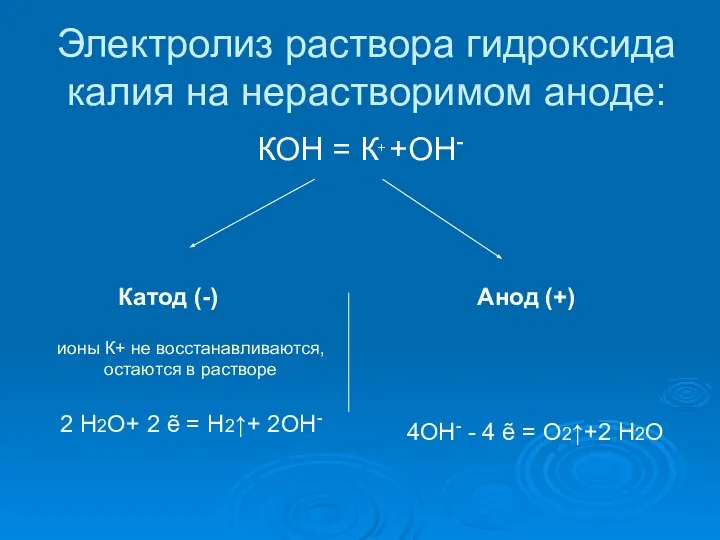
- 15. Электролиз раствора гидроксида калия на нерастворимом аноде: КОН = К+ +ОН- Катод (-) Анод (+) ионы
- 16. 2 Н2О+ 2 ẽ = Н2↑+ 2ОН- 2 4ОН- 4 ẽ = О2↑+2 Н2О 1 2
- 17. Суммарное молекулярное уравнение: 2 Н2О Электролиз 2Н2↑+ О2↑
- 18. б) Если анод РАСТВОРИМЫЙ, то окисляется металл анода, несмотря на природу аниона: Mnn++ - n ẽ
- 20. Скачать презентацию

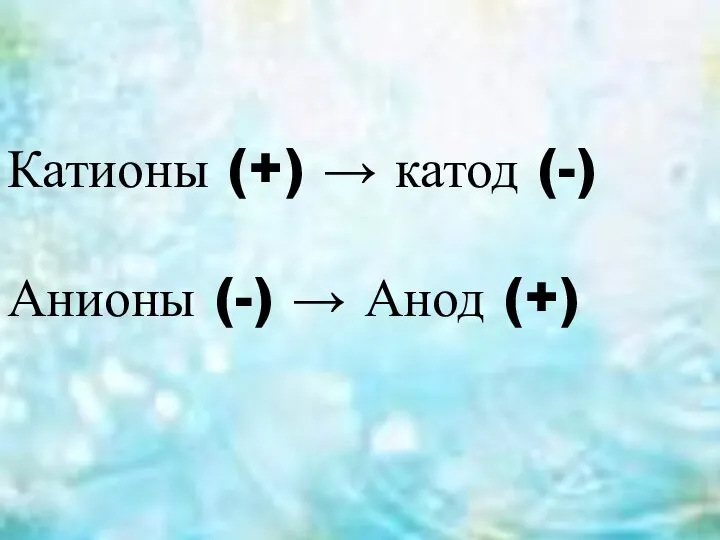










 Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Углерод и его свойства
Углерод и его свойства Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Substanță chimică
Substanță chimică Устный журнал из истории развития химии
Устный журнал из истории развития химии Своя игра по химии
Своя игра по химии Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Полимеры
Полимеры Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Органическая химия "Жиры"
Презентация на тему Органическая химия "Жиры"  Реакционная способность органических соединений
Реакционная способность органических соединений Реакции обмена
Реакции обмена Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Простые и сложные вещества
Простые и сложные вещества Алюминий. Из истории открытия
Алюминий. Из истории открытия Строение атома
Строение атома f8ea0c69dfd043588bd2a8735e944773
f8ea0c69dfd043588bd2a8735e944773 Продолжение классификации
Продолжение классификации Алюминий
Алюминий Химическая кинетика. Факторы, влияющие на скорость реакции
Химическая кинетика. Факторы, влияющие на скорость реакции Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы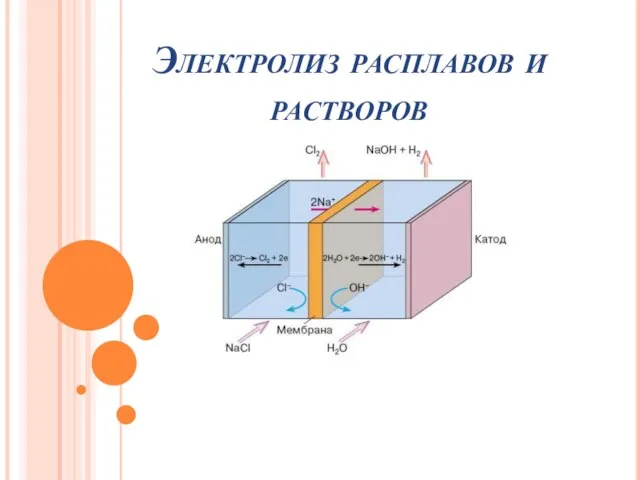 Электролиз расплавов растворов
Электролиз расплавов растворов Физическая химия, термодинамика
Физическая химия, термодинамика Физические и химические свойства алкенов
Физические и химические свойства алкенов