Содержание
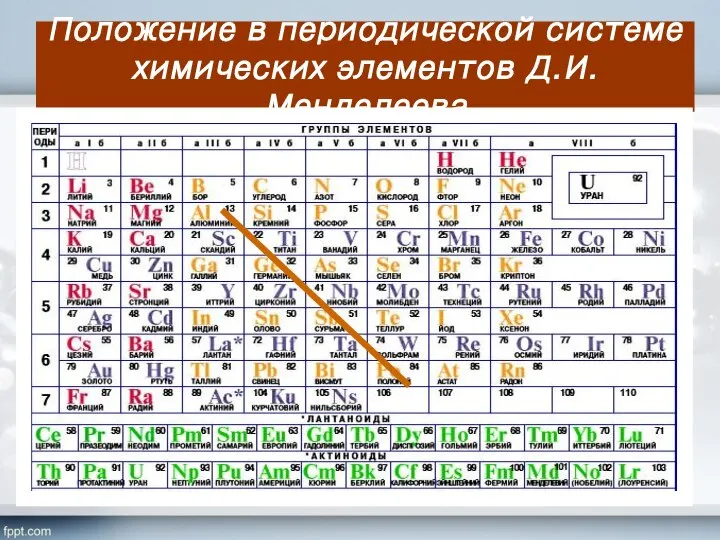
- 2. Положение в периодической системе химических элементов Д.И.Менделеева
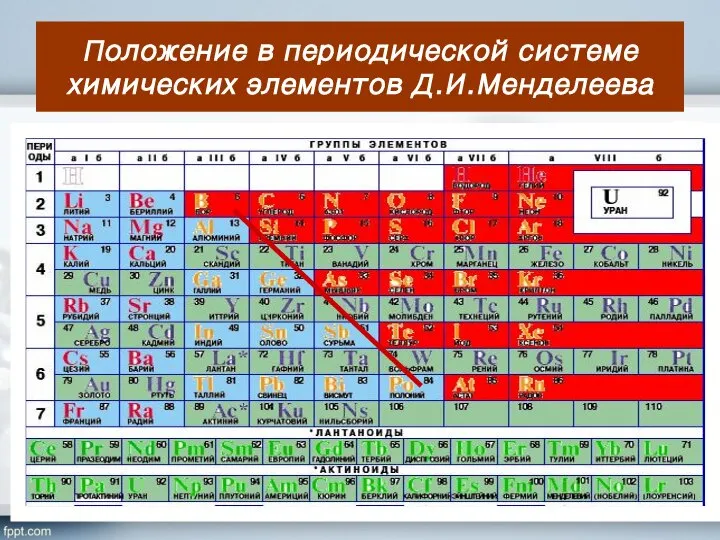
- 3. Положение в периодической системе химических элементов Д.И.Менделеева
- 4. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
- 5. Электроотрицательность – это свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары
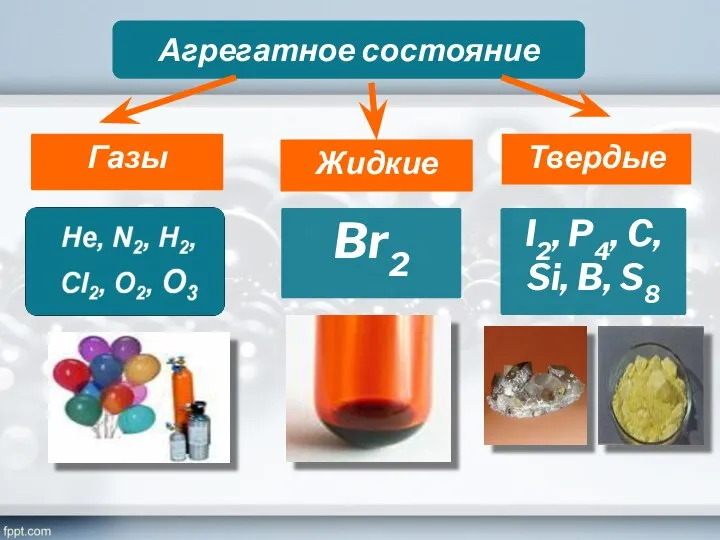
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
- 7. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
- 8. Цвет неметаллов КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
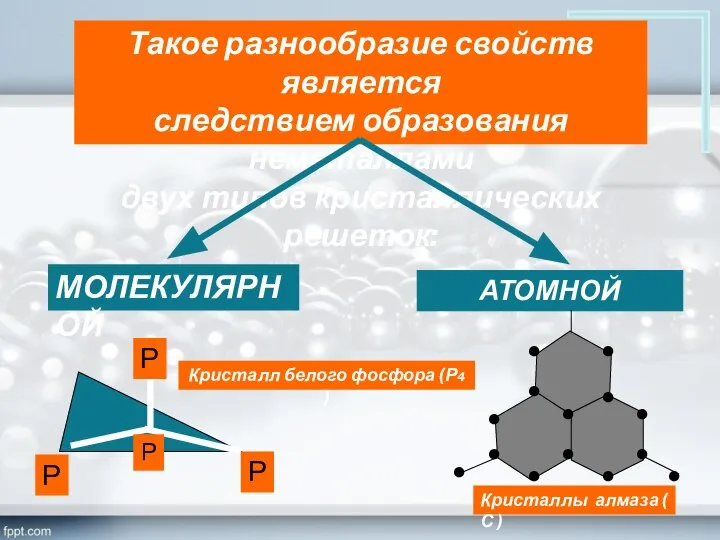
- 9. В чем причина разнообразия физических свойств у неметаллов ?
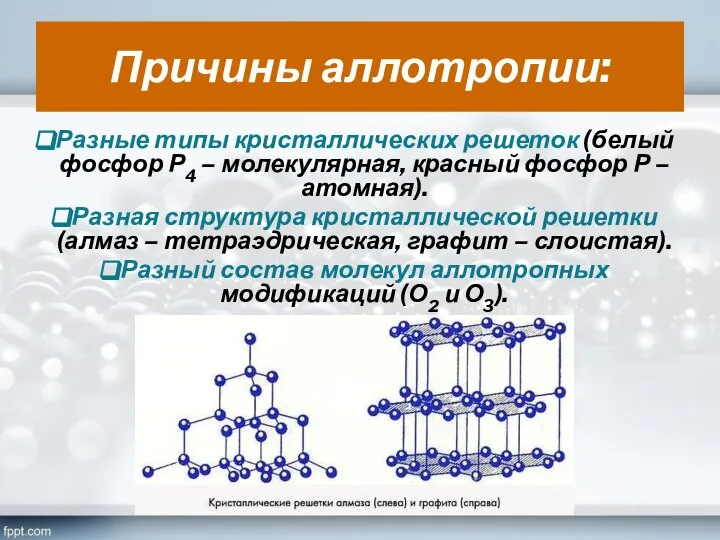
- 10. Такое разнообразие свойств является следствием образования неметаллами двух типов кристаллических решеток: МОЛЕКУЛЯРНОЙ АТОМНОЙ Р Р Р
- 11. Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же
- 12. Причины аллотропии: Разные типы кристаллических решеток (белый фосфор Р4 – молекулярная, красный фосфор Р – атомная).
- 13. Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и
- 14. Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
- 15. Кислород O2- газ, без цвета, вкуса и запаха, плохо растворим в воде, в жидком состоянии светло-голубой,
- 17. Скачать презентацию









 Электролиз. Применение электролиза
Электролиз. Применение электролиза Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Карбоновые кислоты
Карбоновые кислоты Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Алкины
Алкины Строение атома
Строение атома f8ea0c69dfd043588bd2a8735e944773
f8ea0c69dfd043588bd2a8735e944773 Классификация неорганических веществ
Классификация неорганических веществ Алканы – строение, химические свойства
Алканы – строение, химические свойства Плотность вещества
Плотность вещества Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7 Щелочные металлы
Щелочные металлы Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Постулаты Онзагера
Постулаты Онзагера Химические свойства алканов
Химические свойства алканов Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Соли. Классификация солей
Соли. Классификация солей Красители vs пигменты
Красители vs пигменты Лекции_ ОБМЕН ЛИПИДОВ
Лекции_ ОБМЕН ЛИПИДОВ Углеводы
Углеводы Альдегиды
Альдегиды Спирты. Классификация
Спирты. Классификация Пероксид водорода
Пероксид водорода Химическое равновесие в гомогенных системах
Химическое равновесие в гомогенных системах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Основы химической термодинамики
Основы химической термодинамики Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений