Содержание
- 2. Тема урока: Фосфорная кислота и ее свойства.
- 3. Сегодня на уроке мы должны: Образовательные: Изучить физические и химические свойства фосфорной кислоты через проведение химического
- 4. Сегодня на уроке мы должны: План: 1. Молекулярная формула фосфорной кислоты. 2. Получение и физические свойства.
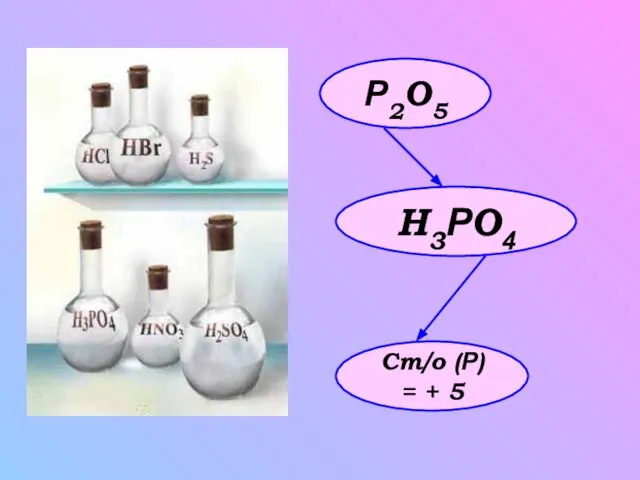
- 5. Р2O5 H3РO4 Ст/о (Р) = + 5
- 6. Молекулярная формула фосфорной кислоты и физические свойства: твердое бесцветное, кристаллическое вещество, хорошо растворимое в воде в
- 7. Производство фосфорной кислоты. а) Горение фосфора в ложечке, которую вносят в колбу. 2Р+5О2 = Р2О5 После
- 8. Химические свойства общие с другими кислотами: Водный раствор кислоты изменяет окраску индикаторов. Диссоциирует в 3 ступени:
- 9. Специфические свойства фосфорной кислоты: 6 а) При нагревании постепенно превращается в метафосфорную кислоту 2Н3РО4 = Н4Р2О7
- 10. H3РO4
- 11. Выберите вещества с которыми будет реагировать фосфорная кислота: КОН, Си, К2SО3, СО2, NО? 2. Какому молекулярному
- 13. Скачать презентацию








 Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ"  Жемчужины химии
Жемчужины химии Карбонаты. Лекция 12
Карбонаты. Лекция 12 Органическая химия. Йенс Якоб Берцелиус (1779 - 1848)
Органическая химия. Йенс Якоб Берцелиус (1779 - 1848) Вуглеводні. Метан як представник насичених вуглеводнів
Вуглеводні. Метан як представник насичених вуглеводнів Порох: из грязи в князи
Порох: из грязи в князи Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки
Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич
Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич Презентация на тему Неогранические соединения. Периодическая таблица
Презентация на тему Неогранические соединения. Периодическая таблица  Обмен нуклеопротеинов в организме
Обмен нуклеопротеинов в организме Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Нуклеирующие добавки
Нуклеирующие добавки Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Количество вещества
Количество вещества Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Микроструктура железоуглеродистых сплавов в равновесном состоянии
Микроструктура железоуглеродистых сплавов в равновесном состоянии Обобщающий урок по теме: Изменения происходящие с веществами
Обобщающий урок по теме: Изменения происходящие с веществами Презентация на тему Молярный объем
Презентация на тему Молярный объем  Презентация на тему Углеродные нанотрубки
Презентация на тему Углеродные нанотрубки  Химия функциональных материалов. Адсорбция
Химия функциональных материалов. Адсорбция Щелочно-земельные металлы и магний
Щелочно-земельные металлы и магний Реакторы периодического действия. (Лекция 4)
Реакторы периодического действия. (Лекция 4) Викторина: А не химик ли ты?
Викторина: А не химик ли ты? Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Тест-методы анализа объектов окружающей среды
Тест-методы анализа объектов окружающей среды Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Алюминий. Положение алюминия в периодической системе и строение его атома
Алюминий. Положение алюминия в периодической системе и строение его атома Среды для культивирования эмбрионов-история разработки и составы
Среды для культивирования эмбрионов-история разработки и составы