Содержание
- 2. Спирты. Общая формула, номенклатура. Спирты – это производные углеводородов, в которых группа –ОН непосредственно не связана
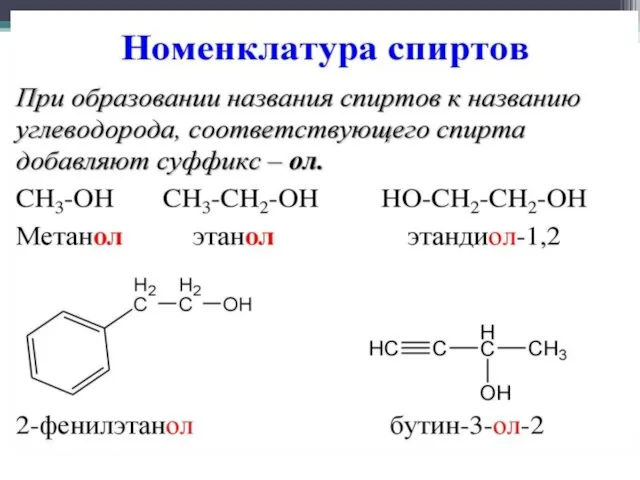
- 3. Номенклатура спиртов.
- 4. Классификация спиртов. 1.По строению углеводородного радикала. 2.По числу гидроксильных групп. 3.По характеру атома углерода.
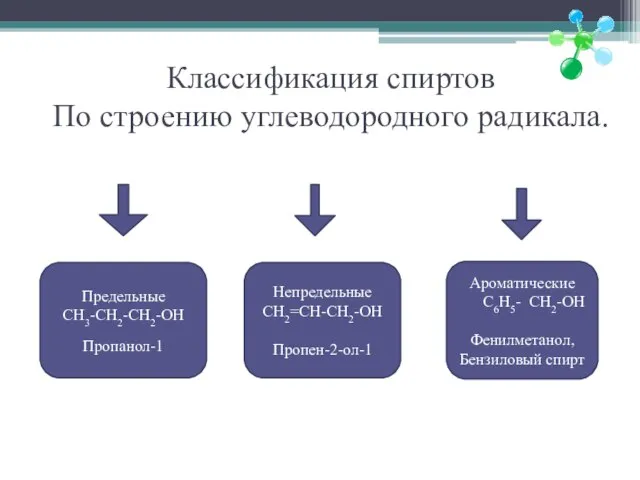
- 5. Классификация спиртов По строению углеводородного радикала. Предельные CH3-CH2-CH2-OH Пропанол-1 Непредельные CH2=CH-CH2-OH Пропен-2-ол-1 Ароматические C6H5- CH2-OH Фенилметанол,
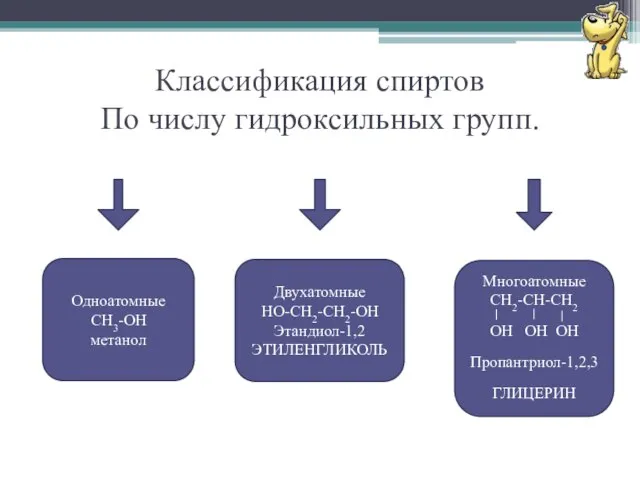
- 6. Классификация спиртов По числу гидроксильных групп. Одноатомные CH3-OH метанол Двухатомные HO-CH2-CH2-OH Этандиол-1,2 ЭТИЛЕНГЛИКОЛЬ Многоатомные CH2-СH-CH2 OH
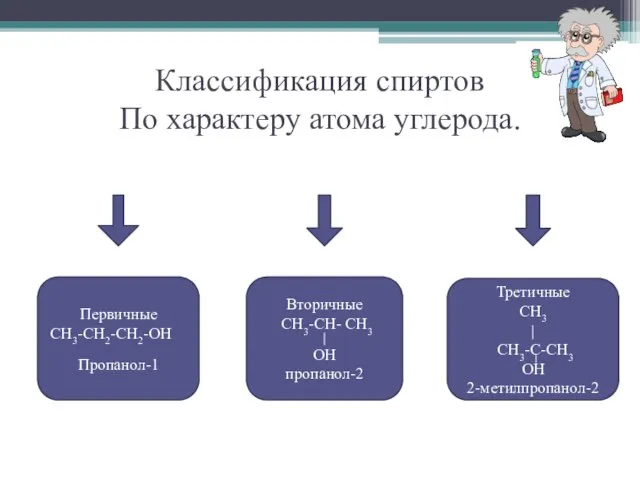
- 7. Классификация спиртов По характеру атома углерода. Первичные СН3-СН2-СН2-ОН Пропанол-1 Вторичные СН3-СН- СН3 OH пропанол-2 Третичные СН3
- 8. Изомерия 1.Углеродного скелета CH3 CH3-CH-CH2-OH CH3-C-OH CH3 CH3 2-метилпропанол-1 2-метилпропанол-2 2. Положения гидроксильной группы CH3-CH2-CH2-OH CH3-CH-CH3
- 9. Физические свойства Спирты имеющие в составе с 1 по 10 углеродных атомов – жидкости, свыше 11-
- 10. Химические свойства спиртов 1. Взаимодействие со щелочными металлами C2H5OH+2Na= C2H5ONa+H2 2. Взаимодействие с галогеноводородами C2H5OH+HBr C2H5Br+H2O
- 11. Химические свойства спиртов 5. Внутримолекулярная дегидратация (в присутствии серной кислоты) C2H5OH → CН2 = CН2 +
- 12. Химические свойства спиртов Этим способом получают простейшие простые эфиры - диэтиловый, дипропиловый и дибутиловый эфиры и
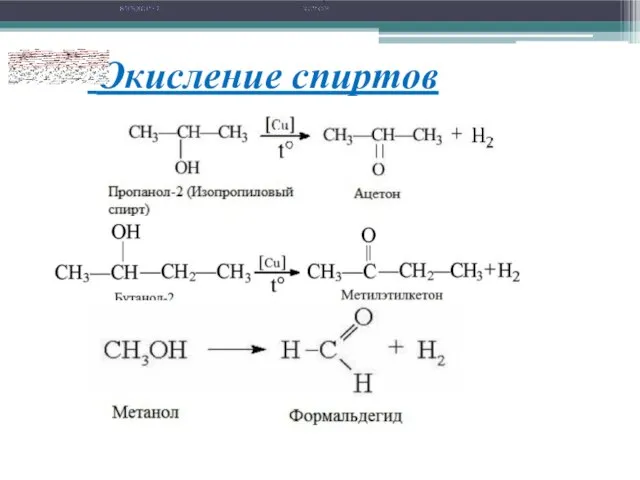
- 13. 7. О к и с л е н и е с п и р т о
- 14. Окисление спиртов Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны. Образующиеся при окислении
- 15. Окисление спиртов 5) Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого
- 16. Окисление спиртов 7) Каталитическое дегидрирование первичных спиртов с образованием альдегидов, а вторичных – с образованием кетонов
- 17. Окисление спиртов 3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O (нагревание)
- 18. Окисление многоатомных спиртов Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или
- 19. Способы получения 1.Гидратацией алкенов СН2=СН2+ Н2О →СН3-СН2-ОН 2.Специфические а)Метанола – из синтез – газа СО+2Н2→СН3ОН б)
- 20. Применение этилового спирта В медицине этиловый спирт в первую очередь используется как антисептик. Дубящие свойства 96
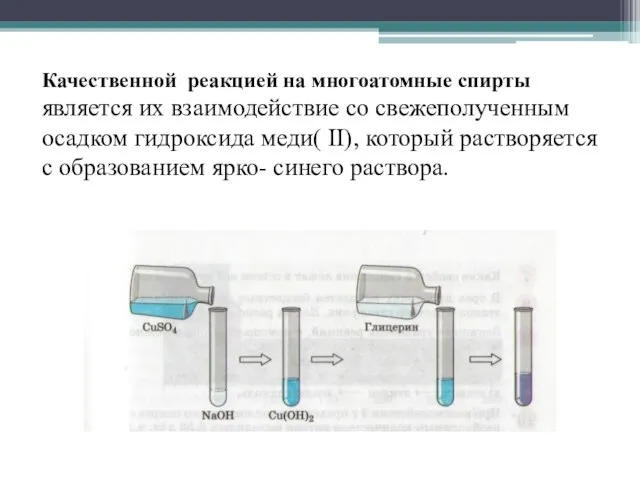
- 21. Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди( II), который растворяется
- 23. Скачать презентацию














 Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе)
Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе) Никель
Никель Классификация пластмасс. Свойства и применение пластмасс
Классификация пластмасс. Свойства и применение пластмасс Классификации по атомному весу
Классификации по атомному весу Исследование фармакологических препаратов на хлориды, методом аргентометрии
Исследование фармакологических препаратов на хлориды, методом аргентометрии Газовые законы
Газовые законы Гидролиз солей
Гидролиз солей Органическая химия
Органическая химия Пятая группа элементов
Пятая группа элементов Олимпиада Ломоносов
Олимпиада Ломоносов Сернистый ангидрид SO2. Диоксид серы
Сернистый ангидрид SO2. Диоксид серы Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток  Спирты и фенолы
Спирты и фенолы Презентация на тему Значение Периодического закона Д.И.Менделеева
Презентация на тему Значение Периодического закона Д.И.Менделеева  Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Классификация органических веществ
Классификация органических веществ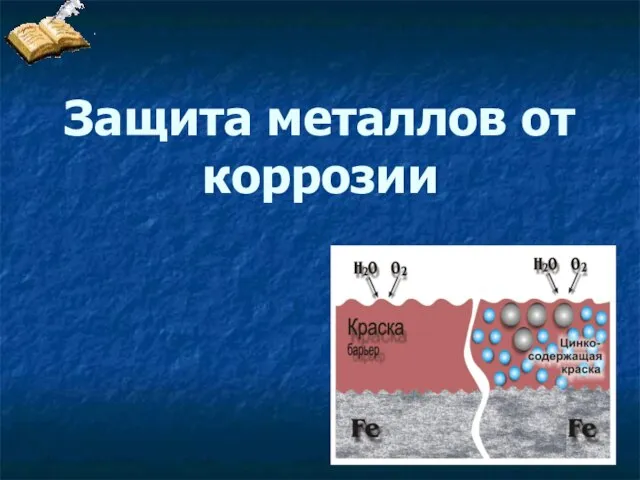 Защита металлов от коррозии
Защита металлов от коррозии Менделеев Дмитрий Иванович
Менделеев Дмитрий Иванович Химические уравнения
Химические уравнения Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Опасная бытовая химия!
Опасная бытовая химия! Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Водород. Вода
Водород. Вода Сложные эфиры. Жиры
Сложные эфиры. Жиры