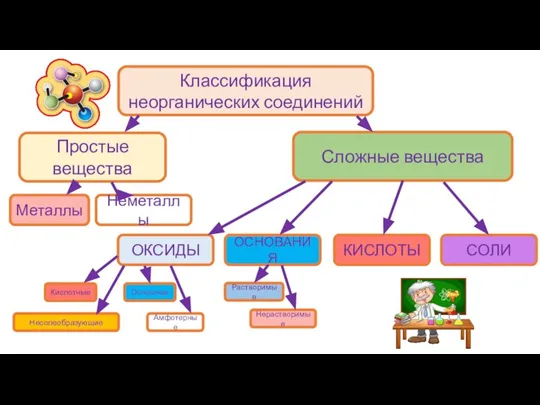
Слайд 3Классификация неорганических соединений
Простые вещества
Сложные вещества
Металлы
Неметаллы
ОКСИДЫ
ОСНОВАНИЯ
КИСЛОТЫ
СОЛИ
Кислотные
Основные
Амфотерные
Несолеобразующие
Растворимые
Нерастворимые
Слайд 4Химические свойства оксидов
Кислотные
Основные
Амфотерные
Несолеобразующие оксиды: NO, CO, N2O, SiO
(не проявляют характерных основных или

кислотных свойств,
им не соответствуют гидроксиды)
Слайд 5Химические свойства кислот
Выучить формулы и названия неорганических кислот!!!
Первое правило ряда напряжений (активности):
С

растворами кислот взаимодействуют металлы, которые расположены левее водорода
Слайд 6Химические свойства оснований
Запомни:
Водный раствор аммиака NH3 H2O – основание, образует сложный однозарядный

катион аммония NH4 и существует только в растворе (нашатырный спирт). Он легко разлагается на аммиак и воду!
Слайд 7Химические свойства солей
Второе правило ряда напряжений (активности):
Каждый металл вытесняет из растворов солей

все другие металлы, расположенные правее его в ряду напряжений.
Условия протекания реакции:
А) Обе соли должны быть растворимы.
Б) Металлы не должны взаимодействовать с водой
(поэтому металлы 1 и 2 групп главных подгрупп не вытесняют другие металлы из растворов солей)






 Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов
Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Основные законы химии
Основные законы химии Ацетилен
Ацетилен Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Декарбонизаторы. Декарбонизация
Декарбонизаторы. Декарбонизация Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Проблемное обучение на уроках химии
Проблемное обучение на уроках химии Галогены. Их значение в жизни человека
Галогены. Их значение в жизни человека Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Компетентностный подход в обучении химии "Плохой учитель преподносит истину, хороший учит ее находить» А. Дист
Компетентностный подход в обучении химии "Плохой учитель преподносит истину, хороший учит ее находить» А. Дист Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Строение электронных оболочек атомов. Электроны в атоме
Строение электронных оболочек атомов. Электроны в атоме Классификация органических соединений
Классификация органических соединений 6efbceb9eca3e929
6efbceb9eca3e929 Физические свойства металлов
Физические свойства металлов Спирты. Строение
Спирты. Строение Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Кислоты
Кислоты Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12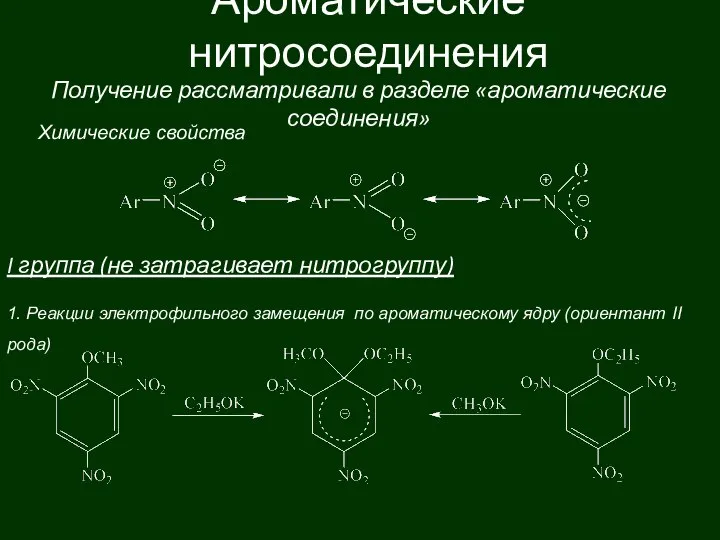 Ароматические нитросоединения
Ароматические нитросоединения Свойства нефти
Свойства нефти Массовая доля растворённого вещества
Массовая доля растворённого вещества