Слайд 2Цели урока:
Образовательная цель:
Знать сущность степени окисления, окислительно-восстановительных процессов, происходящих с

веществами, изменение окислительно-восстановительных свойств элементов в периодах и группах в ПСХЭ Д И. Менделеева, основные окислители и восстановители.
Слайд 3Уметь определять степени окисления элементов в простых и сложных веществах, различать понятия:

степень окисления, валентность и заряд иона, составлять уравнения окислительно-восстановительных реакций методом электронного баланса, определять окислительно-восстановительные свойства веществ, предсказывать продукты реакций, раскрывать сущность окислительно- восстановительных процессов.
Уметь сравнивать, находить причинно-следственные связи, анализировать, делать выводы, работать с алгоритмами, наблюдать, работать в парах.
Слайд 4Воспитательная цель:
Уметь слушать учителя и своих одноклассников, быть внимательным к себе и

окружающим, оценивать себя и других, вести беседу.
Слайд 5Учитель: С окислительно-восстановительными реакциями связаны природные процессы обмена веществ, брожения, круговорота веществ

в природе. Эти реакции можно наблюдать при сгорании топлива, в процессе коррозии металлов, при электролизе, выплавке металлов.
ОВР – реакции, протекающие с изменением степени окисления элементов. Что такое степень окисления?
Слайд 6Ученик: Степень окисления – условный заряд атома в молекуле, вычислительный исходя из

предположения, что все связи в соединении ионные (то есть электронные пары полностью смещены в сторону атомов с большей электроотрицательностью, а соединение нейтральное). Степень окисления может быть положительной, отрицательной, нулевой.
Слайд 7Учитель: Как можно определить степень окисления?
Ученик: Правила определения степени окисления:
В простом веществе

элемент имеет нулевую степень окисления (К0,О20);
Водород в соединениях (исключение –гидриды металлов NaH-1, CaH2-1 и др.) имеет степень окисления +1;
Кислород в соединениях (исключение пероксиды [-1] и F2O[+2] имеет степень окисления -2;
Степень окисления металлов в соединениях положительная и зависит от валентности, у щелочных металлов +1, у щелочноземельных металлов +2, у алюминия+3.
Слайд 8Ученик: Правила определения степени окисления:
В простом веществе элемент имеет нулевую степень окисления

(К0,О20);
Водород в соединениях (исключение –гидриды металлов NaH-1, CaH2-1 и др.) имеет степень окисления +1;
Кислород в соединениях (исключение пероксиды [-1] и F2O[+2] имеет степень окисления -2;
Степень окисления металлов в соединениях положительная и зависит от валентности, у щелочных металлов +1, у щелочноземельных металлов +2, у алюминия+3.
Слайд 9В молекуле сумма степень окисления всех элементов равна нулю, в ионе алгебраическая

сумма степеней окисления равна заряду иона.
К2+1Mn(Х)O4-2 К2 +1Сr2 (х)O7-2
2(+1)+х+4(-1)=0 2(+1)+2х+7(-2)=0
Х=+6 х=+6
К2+1Mn+6O4-2 К2 +1Сr2+6O7-2
Слайд 10 Задания на повторение:
1. Определите степени окисления всех атомов в соединениях:
а)

KNO2 д) H2SO4
б) KMnO4 ж) NH3
в) NaH з) H2S
г) FeCL3 и) KCLO3
Слайд 11Учитель: ОВР – реакции, протекающие с изменением степени окисления элементов.
Например, H +2S+6O4-2+Fe0

→ Fe+2S+6O-24 + H02
2H + →H02
Fe0 → Fe+2
Слайд 12Задание:
Среди перечисленных реакций укажите те реакции, которые являются окислительно- восстановительными.
а) H2SO4+BaCl2→BaSO4

+ 2HCL
б) Pb(NO3)2+Zn→Zn(NO3)2 + Pb
в) Pb(NO3)2 + 2HCL →PbCL2 + 2HNO3
г) 2H2S + 3O2→ 3S + 2H2O
Слайд 13Учитель: Окислительно – восстановительные реакции – это такие реакции, в которых одновременно

протекают процессы окисления и восстановления .
Окисление – процесс отдачи электронов атомами, молекулами или ионами. При окислении степень окисления увеличивается. Атомы, молекулы или ионы, которые отдают электроны, называются восстановителями.
Н20 -2е = 2Н+1
Zn0 -2e = Zn+2
Слайд 14 Восстановление – процесс присоединения электронов атомами, молекулами или ионами. Степень окисления

при восстановлении уменьшается. Атомы, молекулы или ионы, которые принимают электроны, называются окислителями.
Br2 0+2e =2Br-1
Zn+2+2e=Zn0
Слайд 15Окисление и восстановление – взаимосвязанные процессы. Число электронов, отданных окислителем в ОВР,

всегда равно числу электронов, принятых восстановителем.
При составлении ОВР используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов. Рассмотрим, как составляется электронный баланс, (алгоритм).
Слайд 16Метод электронного баланса.
Метод электронного баланса.
Пример: Используя метод электронного баланса, расставьте коэффициенты в

уравнении химической реакции:
AL +HCL → ALCL3 +H2
Определите окислитель и восстановитель.
Слайд 17Решение :
Записать схему реакции, например: AL +HCL → ALCL3 +H2
Определите степени окисления

элементов и найти элементы, которые изменяют степени окисления: AL0 +H+1CL-1 → AL+3CL3-1 +H20
3. Написать уравнение процессов окисления и восстановления обязательно учитывать количество атомов элементов, участвующих в процессах:
АL0 -3e = AL+3
2H+1+2e=H20
Слайд 18Решение :
4. Уравнять число отданных и принятых электронов и определить коэффициенты при

окислителе и восстановителе.
АL0 -3e = AL+3 |2-процесс окисления АL 0 -восстановитель
2H+1+2e=H20 |3-процесс восстановления, H+1 – окислитель
-----------------------------------------------------------------
2 АL0+6Н+1 = 2 АL+3 +3Н20
Слайд 19Решение:
5. Перенести полученные коэффициенты с учетом числа атомов элементов, участвующих в процессах,

в молекулярное уравнение и, используя закон сохранения массы, уравнять его.
2AL +6HCL → 2ALCL3 +3H2
Слайд 20 Проверить число атомов каждого элемента в левой и правой частях уравнения:
В

левой части правой части
2 атома AL = 2 атома AL;
6 атомов Н = 6 атомов Н
6 атомов CL = 6 атомов CL
Слайд 21Вывод: реакция уравнена.
Окисление всегда сопровождается восстановлением, восстановление окислением. Не бывает одного

процесса без другого. ОВР – это единство двух противоположных процессов – окисления и восстановления.
Слайд 22Возникают трудности
с определением числа электронов и типа процесса (т.е. +ē

или
– ē). Например, N +5 ? хē →N+2
Можно рекомендовать следующий прием: 5 – 2 = +3
Или алгебраическое уравнение, обозначив число электронов через х. электроны заряжены отрицательно, учтем это при составлении уравнения:
+5 + (-х) = +2
+5 – 2 = х
Х = 3
Надо принять 3 электрона. Записываем это:
N +5 +3ē →N+2 окислитель (восстановитель).
Слайд 23Следующий пример:
N -5 ? хē →N+3
-2 + (-х) = +3
-2 + (-3)

= х
Х = -5
N -2 -5ē →N+3 восстановитель (окисляется).
Слайд 24Задание для закрепления.
Рассмотрите следующие примеры:
а) S+6 →S0 в) S+6→S-2
б) S+4→S-2

г) S+4→S+6
Укажите окислитель и восстановитель в следующих реакциях.
а) N2 + O2 →2NO б) 2 F2 + 7O2 →2 F2O7
в) Fe + S → FeS г) S + O2 → SO2
д) Cu + HNO3 → Cu(NO3)2 + NO↑ + H2O
ж) Mg + H2SO4→Mg SO4+ H2S ↑+ H2O
Слайд 25Домашнее задание:
Расставьте коэффициенты c помощью электронного баланса, укажите окислитель и восстановитель в

следующих реакциях:
a) К + HCL→HCL + H2
б) N2+O2 →N2O3
в) Zn + H2SO4→ Zn SO4+ S↓ + H2O
г) Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O
























 Презентация на тему Спирты (9 класс)
Презентация на тему Спирты (9 класс)  Гетерогенные дисперсные системы
Гетерогенные дисперсные системы Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Электрохимическая коррозия
Электрохимическая коррозия Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции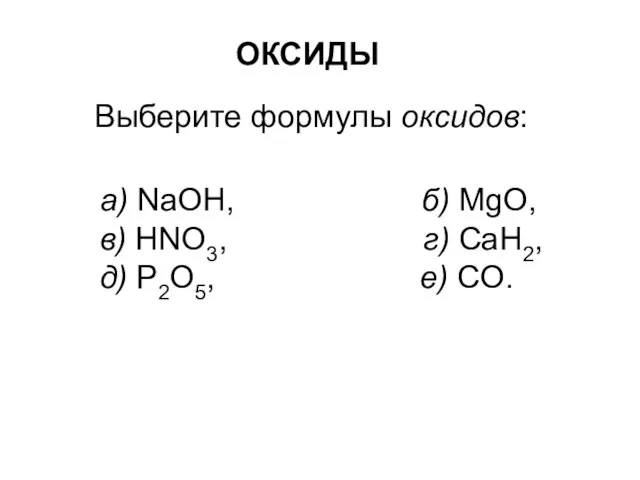 Оксиды
Оксиды Классификация и номенклатура ОС
Классификация и номенклатура ОС Значимые личности в химии
Значимые личности в химии Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Железо в организме человека. Функции железа в организме
Железо в организме человека. Функции железа в организме Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам 4_10.1С Аммиак, производство и применение_Презентация
4_10.1С Аммиак, производство и применение_Презентация Валентность
Валентность Каучук негізіндегі материалдар
Каучук негізіндегі материалдар ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Dereglarea metabolismului
Dereglarea metabolismului Физическая химия, термодинамика
Физическая химия, термодинамика Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Открытый урок на тему: Степень окисления
Открытый урок на тему: Степень окисления Амины. Номенклатура аминов
Амины. Номенклатура аминов Химический алфавит. Алфавит
Химический алфавит. Алфавит Органические вещества
Органические вещества