Содержание
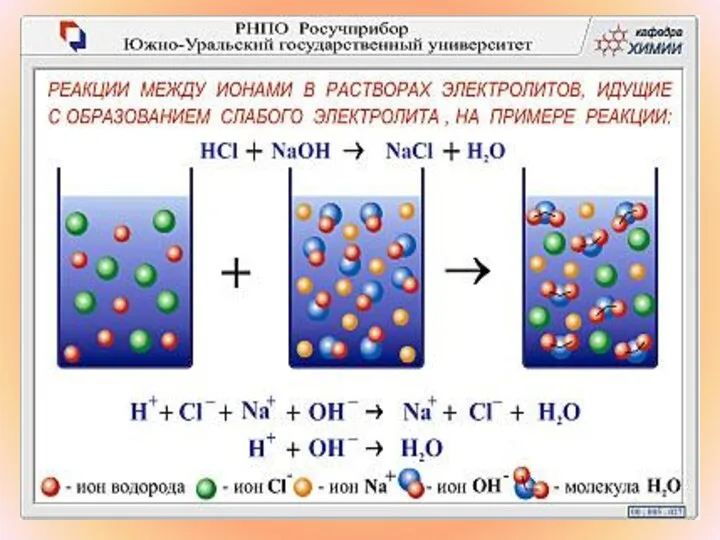
- 2. Полные ионные уравнения – это запись всех веществ в ионной форме, кроме веществ, вышедших из сферы
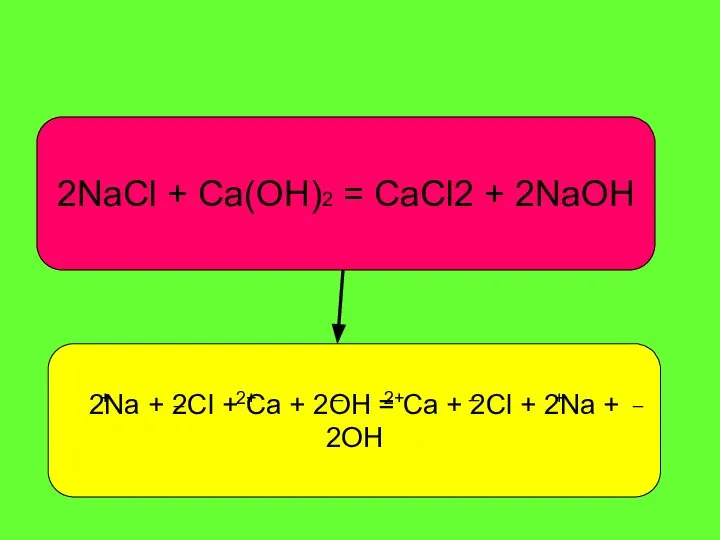
- 3. 2NaCl + Ca(OH)2 = CaCl2 + 2NaOH 2Na + 2Cl + Ca + 2OH = Ca
- 4. Взаимодействие цинка с серной кислотой В пробирку поместите 1 гранулу цинка и прилейте 1 мл концентрированной
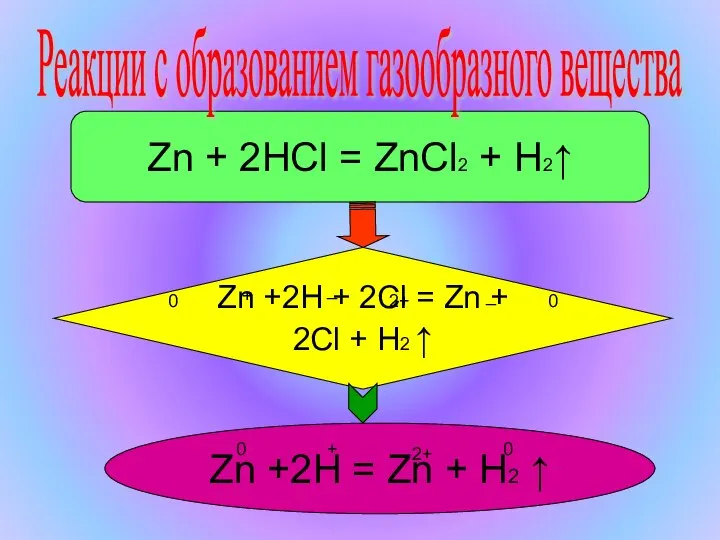
- 5. Zn + 2HCl = ZnCl2 + H2↑ Zn +2H + 2Cl = Zn + 2Cl +
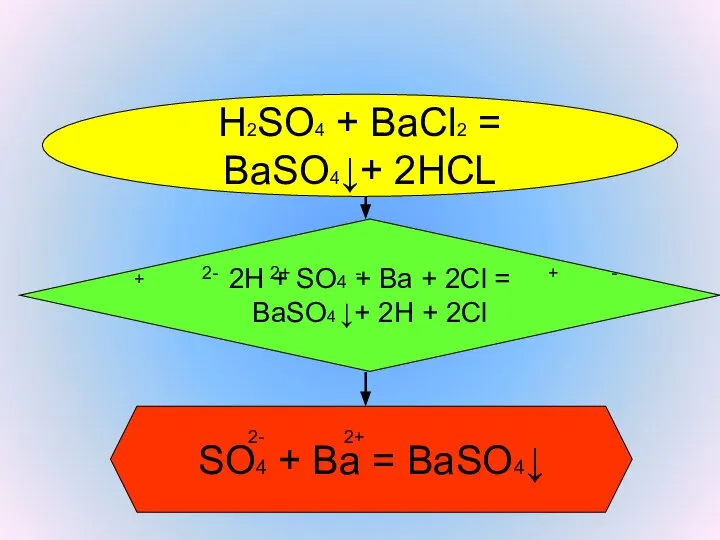
- 7. H2SO4 + BaCl2 = BaSO4↓+ 2HCL Реакция с образованием осадка 2H + SO4 + Ba +
- 8. 1. Если образовался осадок. 2. Если выделяется газообразное вещество. 3. Если образуется малодиссоциированное вещество (например: вода)
- 10. Вспомним Сильные основания – сильные электролиты - щелочи (NaOH, KOH, Ca(OH)2 и другие) Слабые основания –
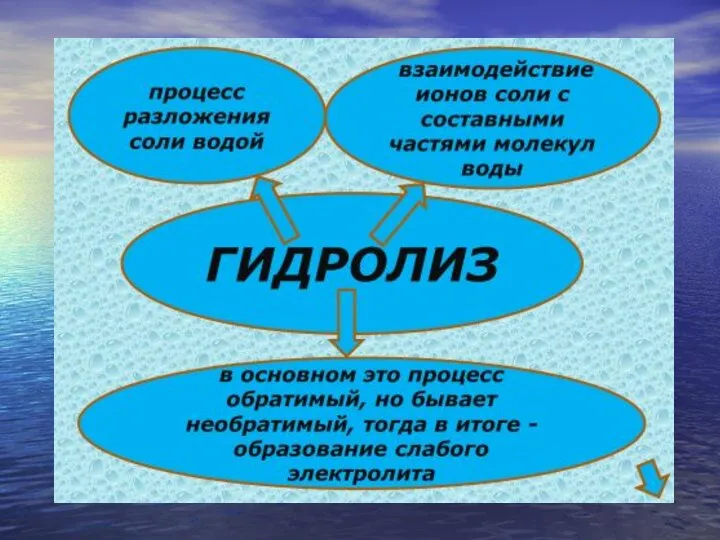
- 12. Алгоритм составления уравнений гидролиза Проверить растворимость соли. Определить состав соли, т.е. указать, каким по силе основанием
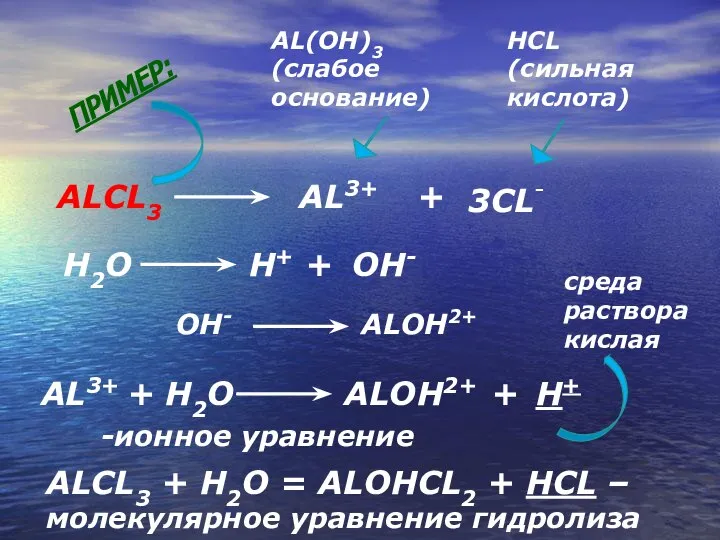
- 13. ALCL3 AL3+ + 3CL- AL(OH)3 (слабое основание) HCL (сильная кислота) AL3+ + H2O H+ OH- ALOH2+
- 15. Скачать презентацию






 Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Химия в моей специальности
Химия в моей специальности Вывод формул химических веществ
Вывод формул химических веществ Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Химия. 8 класс
Химия. 8 класс Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Тест по теме Спирты. Фенол
Тест по теме Спирты. Фенол Характеристика кислорода и серы
Характеристика кислорода и серы Общая характеристика металлов
Общая характеристика металлов Презентация на тему Самородки 9 класс
Презентация на тему Самородки 9 класс  Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Кислоты. Классификация кислот (8 класс)
Кислоты. Классификация кислот (8 класс) Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Углеводы
Углеводы Презентация на тему Подготовка к ГИА по химии
Презентация на тему Подготовка к ГИА по химии  Презентация на тему Лайнус Полинг
Презентация на тему Лайнус Полинг  Контроль знаний на уроках химии
Контроль знаний на уроках химии Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Сплавы цветных металлов
Сплавы цветных металлов Моющие и чистящие средства
Моющие и чистящие средства Химические явления
Химические явления Энергетика хим процессов
Энергетика хим процессов Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Химические свойства металлов
Химические свойства металлов Консультация по химии
Консультация по химии Реакции разложения
Реакции разложения