Содержание
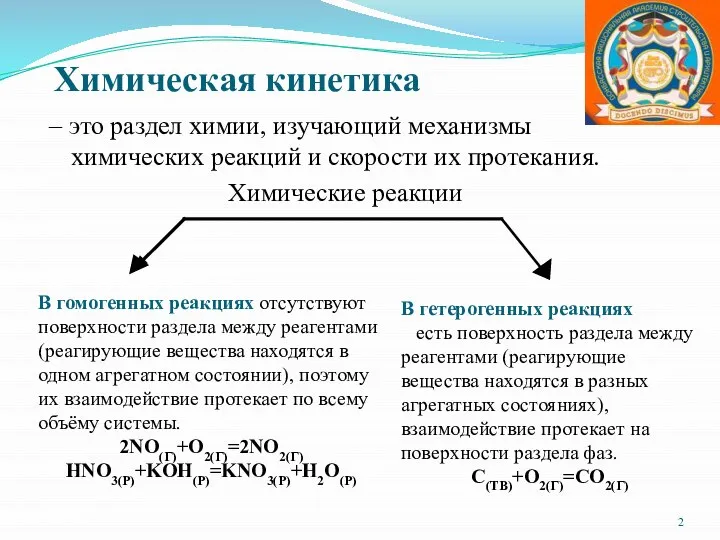
- 2. Химическая кинетика – это раздел химии, изучающий механизмы химических реакций и скорости их протекания. Химические реакции
- 3. Катализ бывает положительный, когда скорость реакции возрастает, и отрицательный, когда скорость реакции уменьшается (в этом случае
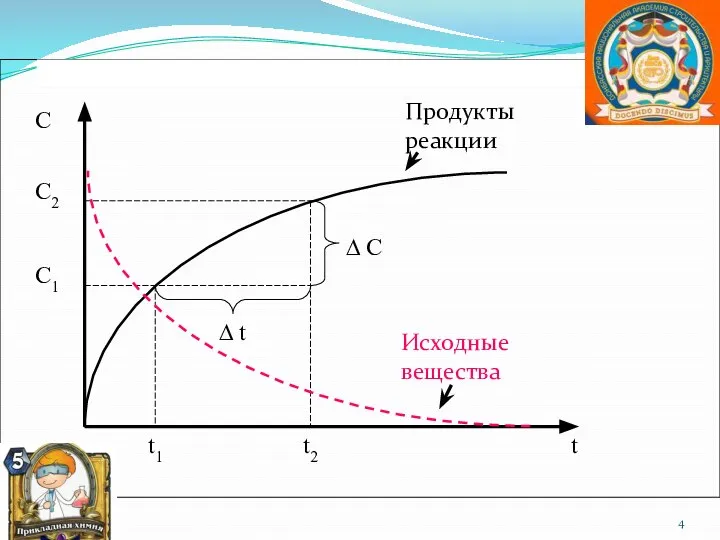
- 4. Продукты реакции Исходные вещества
- 5. Скорость химической реакции - изменение концентрации любого участника реакции в единицу времени: Знак «+» – для
- 6. Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry) van 't Hoff; 30 августа 1852, Роттердам — 1
- 7. Правило Вант-Гоффа: С увеличением температуры на каждые 10º скорость химической реакции возрастает в 2-4 раза: где
- 8. Факторы, влияющие на скорость реакции: природа реагирующих веществ; концентрация; давление (только для газов); температура; наличие катализатора;
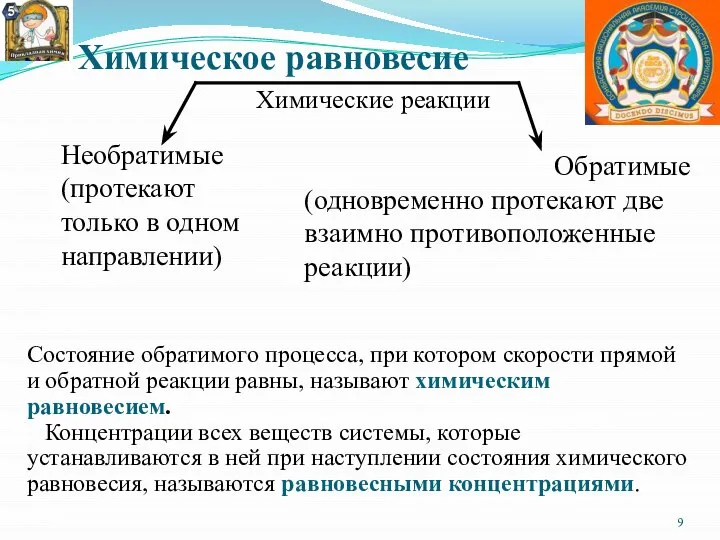
- 9. Химическое равновесие Химические реакции Необратимые (протекают только в одном направлении) Обратимые (одновременно протекают две взаимно противоположенные
- 10. константа химического равновесия Константа химического равновесия - это отношение произведения равновесных концентраций продуктов реакции к произведению
- 11. Смещение равновесия происходит по принципу Ле Шателье: Если на систему, находящуюся в устойчивом равновесии, воздействовать извне,
- 15. для реакции 2SO2+O2=2SO3; ∆H ↑ [SO2] смещает равновесие вправо; ↓ [SO2] смещает равновесие влево; ↑ p
- 17. Скачать презентацию










![для реакции 2SO2+O2=2SO3; ∆H ↑ [SO2] смещает равновесие вправо; ↓ [SO2] смещает](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1036330/slide-14.jpg)
 Скорость химической реакции и химическое равновесие
Скорость химической реакции и химическое равновесие Презентация на тему Гормоны
Презентация на тему Гормоны  Сложные эфиры. Организация внеаудиторной творческой работы учащихся
Сложные эфиры. Организация внеаудиторной творческой работы учащихся Электролитическая диссоциация
Электролитическая диссоциация Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Биоорганическая химия
Биоорганическая химия Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Неметаллы. Общая характеристика
Неметаллы. Общая характеристика валентность (1)
валентность (1) Прикладная химия в системе предпрофильного обучения
Прикладная химия в системе предпрофильного обучения Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Ионная химическая связь
Ионная химическая связь Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Что объединяет вкус яблока, киви, садовой земляники?
Что объединяет вкус яблока, киви, садовой земляники? Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов Викторина Что это?
Викторина Что это? Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Биологическая роль III(A) группы
Биологическая роль III(A) группы АЛЬДЕГИДЫ И КЕТОНЫ
АЛЬДЕГИДЫ И КЕТОНЫ Синтез ланшенгенина дэ
Синтез ланшенгенина дэ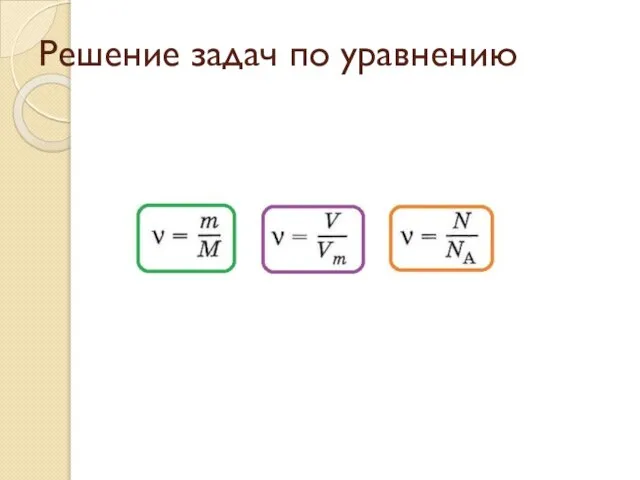 Решение задач по уравнению
Решение задач по уравнению Типы химических реакций. Реакции разложения, реакции соединения.8 класс
Типы химических реакций. Реакции разложения, реакции соединения.8 класс знаки химических элементов,относительная атомная масса
знаки химических элементов,относительная атомная масса Презентация на тему Химические свойства бензола. Получение, применение
Презентация на тему Химические свойства бензола. Получение, применение  Сера
Сера Химическая кинетика и равновесие
Химическая кинетика и равновесие 9-4
9-4 Химик белемнәрне тормышта куллану
Химик белемнәрне тормышта куллану