Содержание
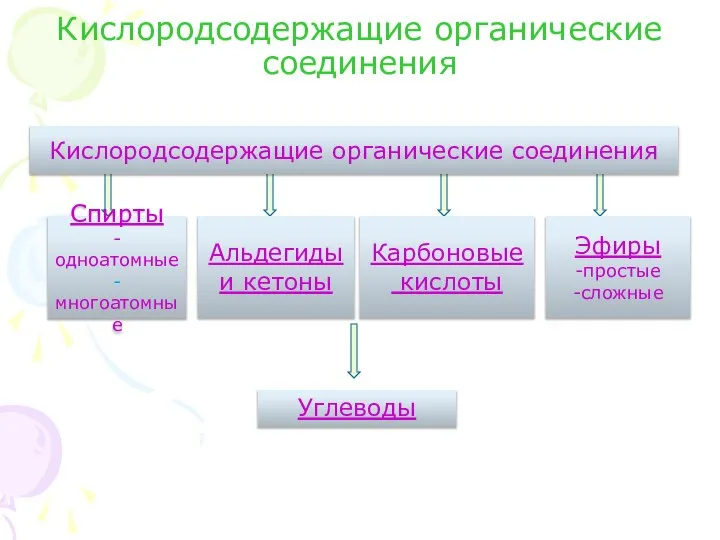
- 2. Кислородсодержащие органические соединения Спирты -одноатомные -многоатомные Альдегиды и кетоны Кислородсодержащие органические соединения Карбоновые кислоты Эфиры -простые
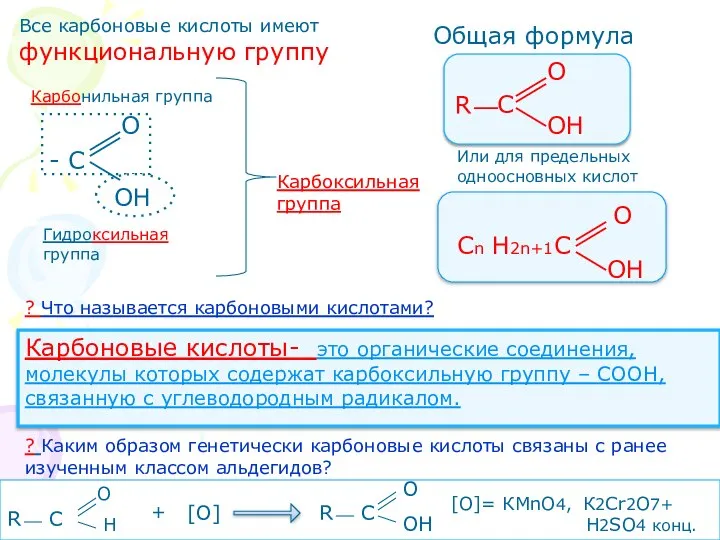
- 3. Задачи 1. Выяснить функциональную группу, общую формулу карбоновых кислот. 2. Сформулировать определение. 3. Изучить классификацию карбоновых
- 4. Все карбоновые кислоты имеют функциональную группу - С ОН О Карбонильная группа Гидроксильная группа Карбоксильная группа
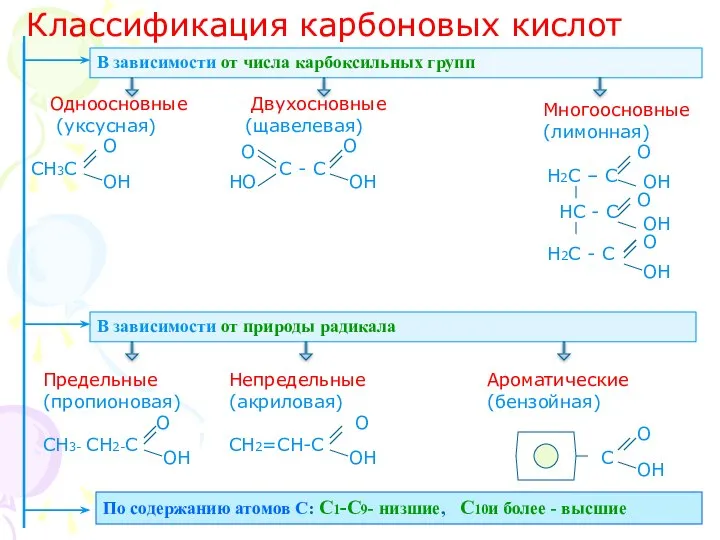
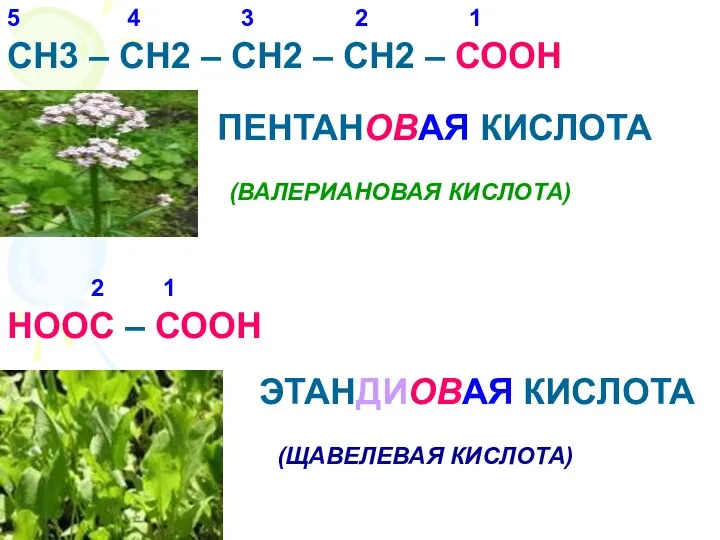
- 5. Классификация карбоновых кислот В зависимости от числа карбоксильных групп Одноосновные Двухосновные (уксусная) (щавелевая) СН3С С -
- 6. Проклассифицируйте предложенные кислоты 1) СH3 – СН2 – СН2 – СН2 - COOH 2) HOOC -
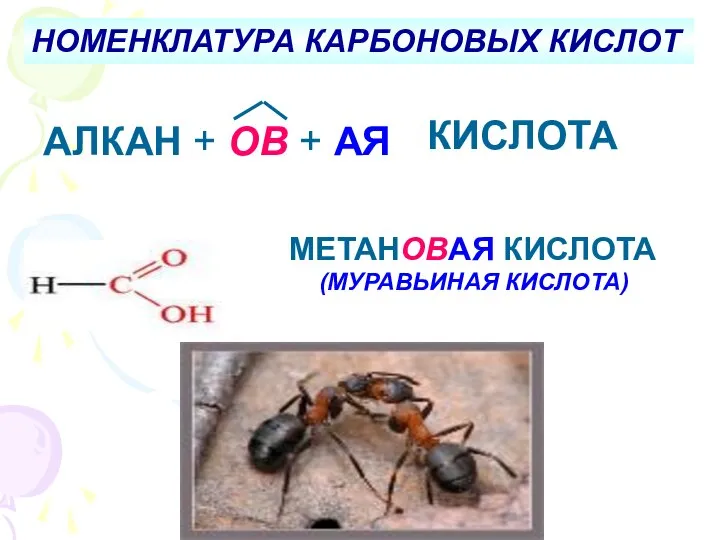
- 7. НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ АЛКАН + ОВ + АЯ КИСЛОТА МЕТАНОВАЯ КИСЛОТА (МУРАВЬИНАЯ КИСЛОТА)
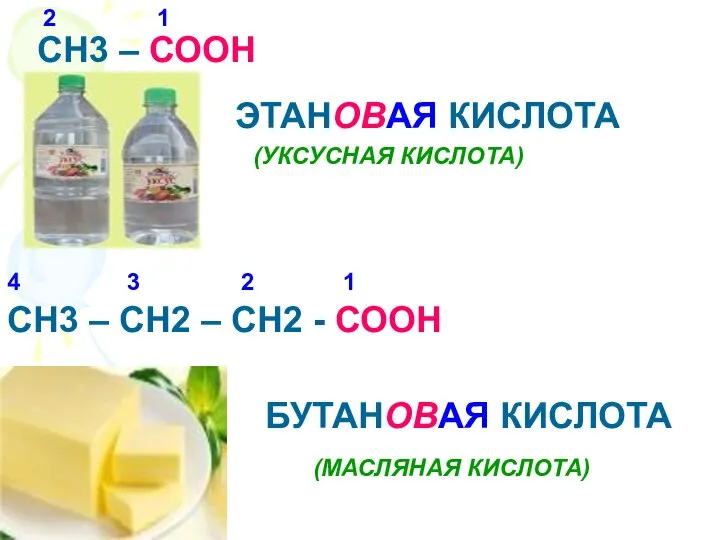
- 8. СН3 – СООН 1 2 ЭТАНОВАЯ КИСЛОТА (УКСУСНАЯ КИСЛОТА) СН3 – СН2 – СН2 - СООН
- 9. СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАНОВАЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) 1 2 3
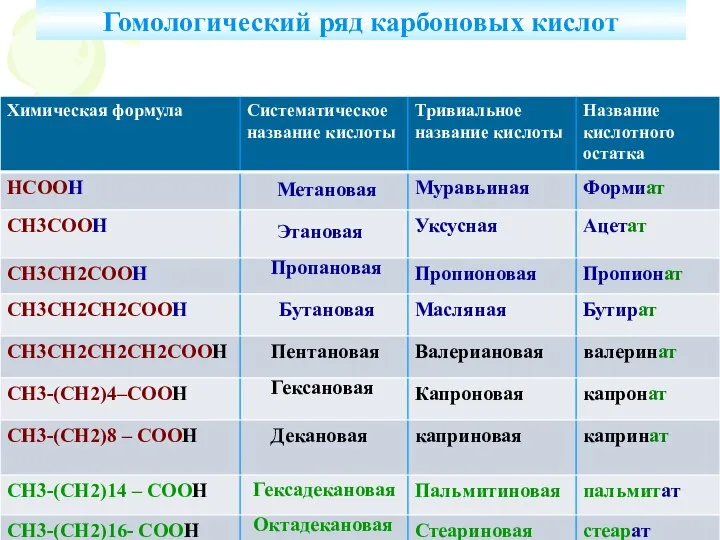
- 10. Гомологический ряд карбоновых кислот Метановая Этановая Пропановая Бутановая Пентановая Гексановая Декановая Гексадекановая Октадекановая
- 11. Алгоритм названия карбоновых кислот: 1. Находим главную цепь атомов углерода и нумеруем её, начиная с карбоксильной
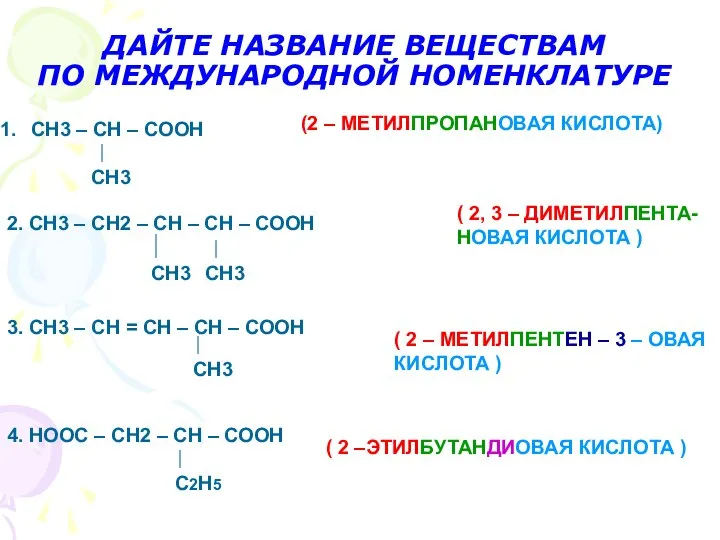
- 12. ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ (2 – МЕТИЛПРОПАНОВАЯ КИСЛОТА) СН3 – СН – СООН 2.
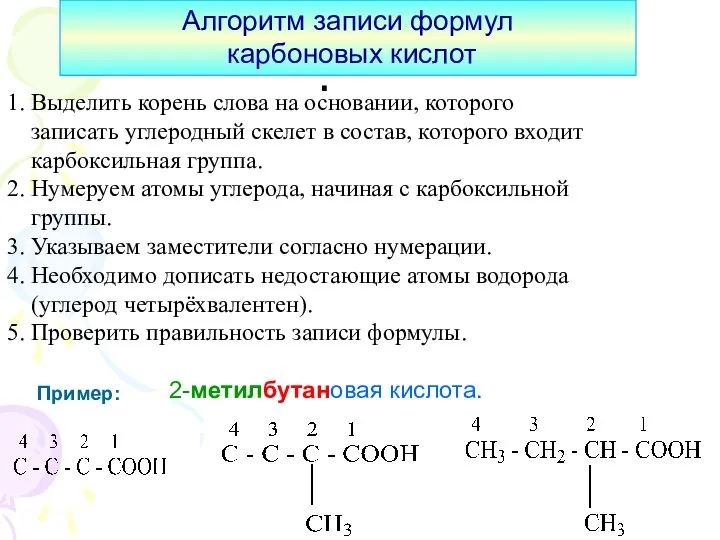
- 13. : 1. Выделить корень слова на основании, которого записать углеродный скелет в состав, которого входит карбоксильная
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА С1 – С3 Жидкости с характерным резким запахом, хорошо растворимые в воде С4 –
- 15. Агрегатное состояние жидкое Цвет бесцветная прозрачная жидкость Запах резкий уксусный Растворимость в воде хорошая Температура кипения
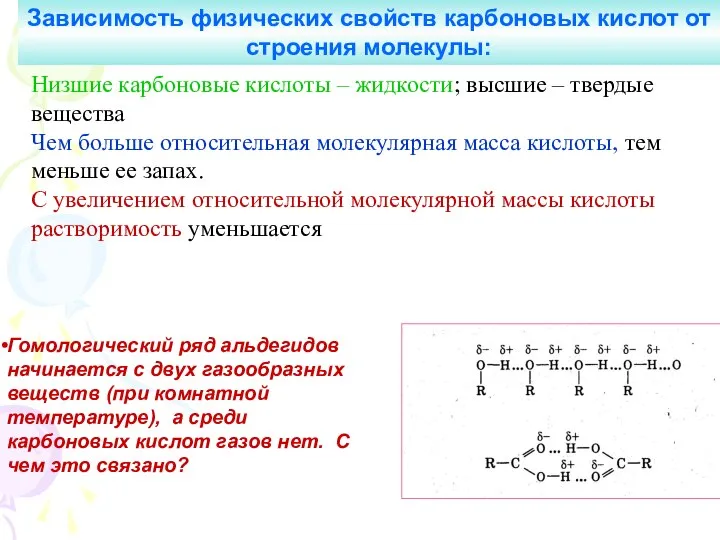
- 16. Низшие карбоновые кислоты – жидкости; высшие – твердые вещества Чем больше относительная молекулярная масса кислоты, тем
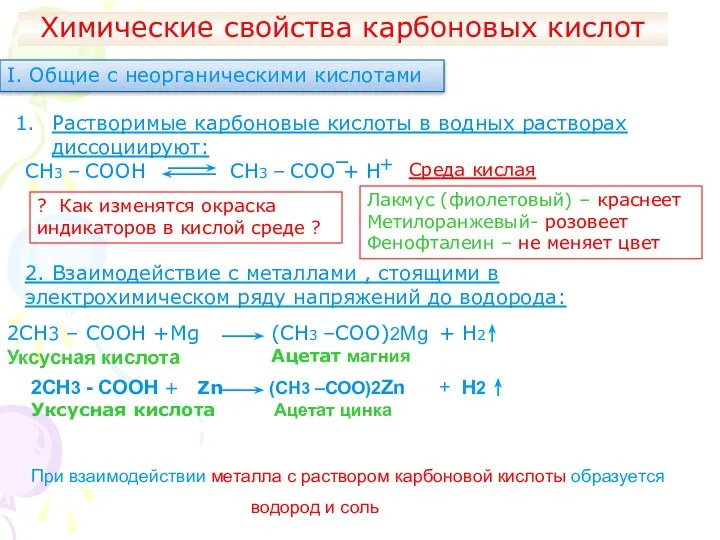
- 17. Химические свойства карбоновых кислот І. Общие с неорганическими кислотами Растворимые карбоновые кислоты в водных растворах диссоциируют:
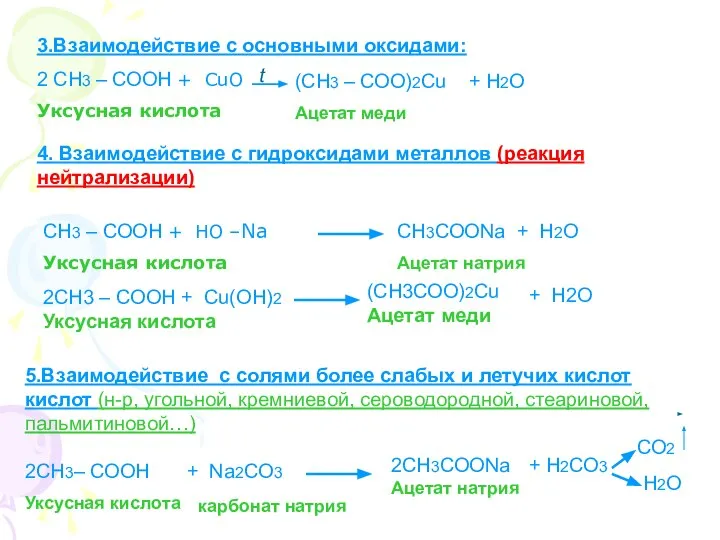
- 18. 3.Взаимодействие с основными оксидами: 2 СН3 – СООН + СuО Уксусная кислота t (СН3 – СОО)2Сu
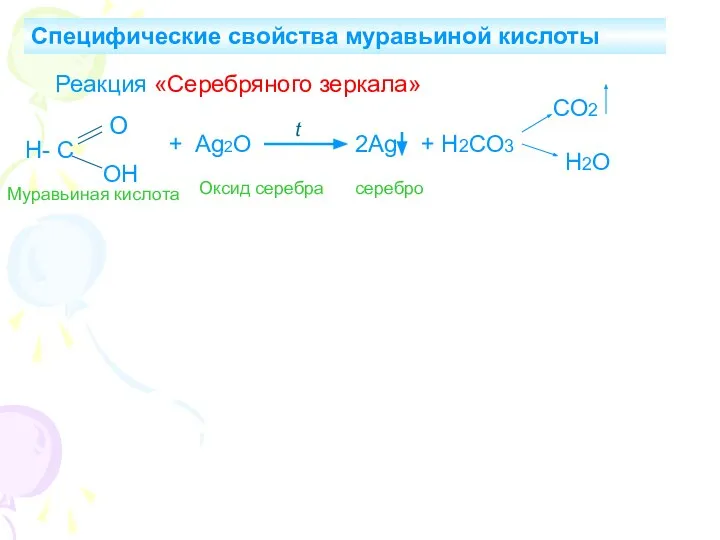
- 19. Специфические свойства муравьиной кислоты Реакция «Серебряного зеркала» Н- С О ОН + Ag2O t 2Ag +
- 20. Нахождение в природе и применение карбоновых кислот Муравьиная кислота(Метановая кислота) -Химическая формула СН2О2, или НСООН. -
- 21. Применение муравьиной кислоты Муравьиная кислота обладает ярко выраженными бактерицидными свойствами. Поэтому ее водные растворы используют как:
- 22. Вопрос: Почему нельзя смачивать водой место муравьиного укуса или ожога крапивой? Это приводит только к усилению
- 23. Уксусная кислота (этановая кислота) Это – первая кислота, полученная и использованная человеком. «Родилась» более 4 тыс.лет
- 24. Применение уксусной кислоты - Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E-
- 25. Применение уксусной кислоты Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска
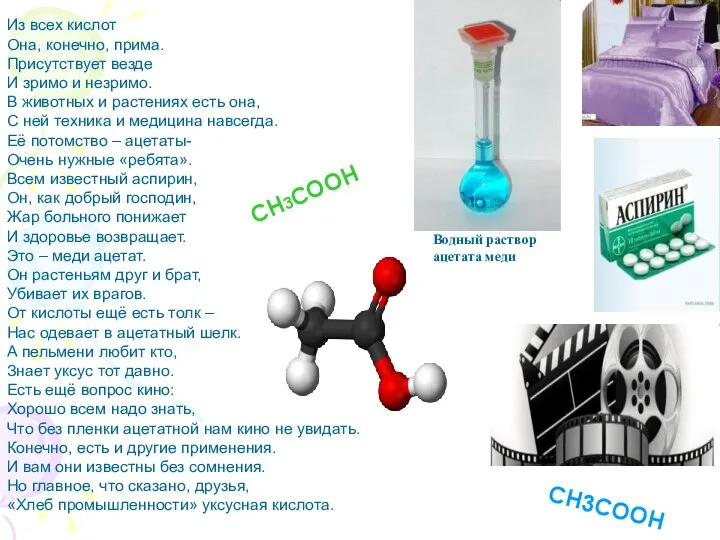
- 26. Из всех кислот Она, конечно, прима. Присутствует везде И зримо и незримо. В животных и растениях
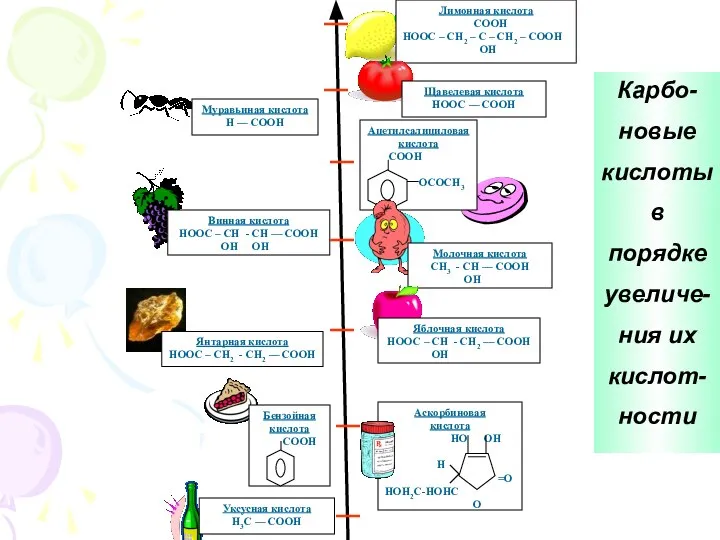
- 27. Карбо- новые кислоты в порядке увеличе- ния их кислот- ности
- 28. Выводы 1.Карбоновые кислоты- это органические соединения, молекулы которых содержат карбоксильную группу – СООН, связанную с углеводородным
- 29. Домашнее задание §12 , упражнения № 5 , 6 стр 91 упр.№9 Царица Клеопатра по совету
- 31. Скачать презентацию













 Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия ÐÐÐÐ ÐÐТÐÐРХÐÐÐЧÐСÐÐÐ¥ Ð ÐÐÐЦÐÐ
ÐÐÐÐ ÐÐТÐÐРХÐÐÐЧÐСÐÐÐ¥ Ð ÐÐÐЦÐÐ Химическая промышленность
Химическая промышленность Индолы. Cтроение индола
Индолы. Cтроение индола Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Синтетические моющие средства
Синтетические моющие средства 10-2 основные положения теории Бутлерова
10-2 основные положения теории Бутлерова Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Скорость химической реакции
Скорость химической реакции Основные понятия химии
Основные понятия химии Амины. Способы получения
Амины. Способы получения Возможности пропедевтического курса химии
Возможности пропедевтического курса химии Пространственное строение органических соединений
Пространственное строение органических соединений Соль - без вины виновата
Соль - без вины виновата Алкены. Ҳимические свойства алкенов
Алкены. Ҳимические свойства алкенов Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Неорганические вещества клетки
Неорганические вещества клетки Оксиды
Оксиды ПЕРІОДИЧНИЙ ЗАКОН
ПЕРІОДИЧНИЙ ЗАКОН Основные понятия химической термодинамики
Основные понятия химической термодинамики Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Разработка электронных образовательных ресурсов в естественнонаучном образовании бакалавров направления Химия
Разработка электронных образовательных ресурсов в естественнонаучном образовании бакалавров направления Химия Каучук
Каучук Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Альдегиды, строение и свойства
Альдегиды, строение и свойства Презентация на тему Комплексные соединения
Презентация на тему Комплексные соединения