Содержание
- 2. Из данных веществ выберите формулы оксидов и оснований P2O5, Cu(OH)2, HCl HNO3, H2SO4, Ca(OH)2, SO3, Al2O3,
- 3. Цель урока: Сформировать представление о кислотах То, что мы знаем, - ограничено; То, что не знаем,
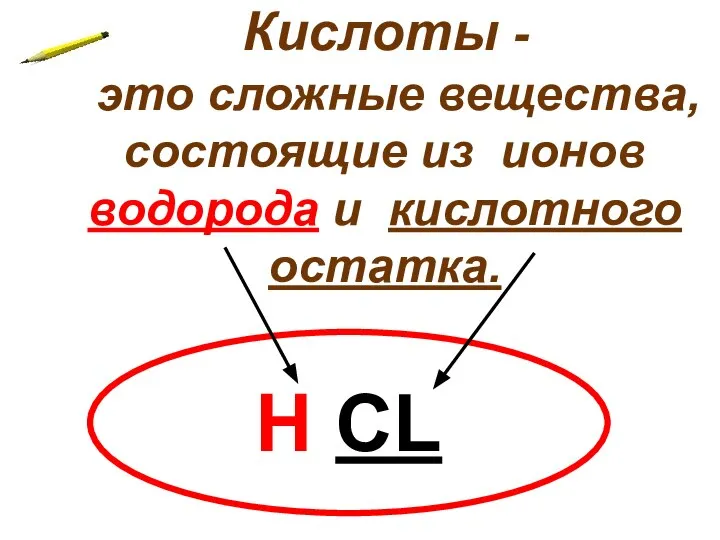
- 4. Кислоты - это сложные вещества, состоящие из ионов водорода и кислотного остатка. Н CL
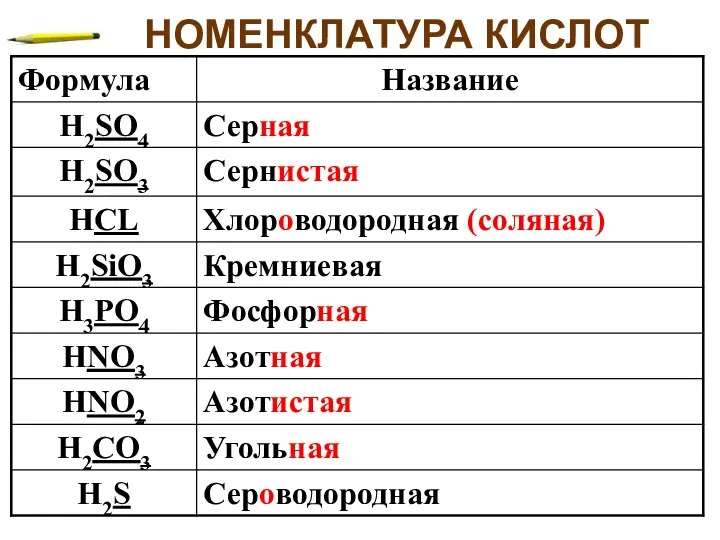
- 5. НОМЕНКЛАТУРА КИСЛОТ
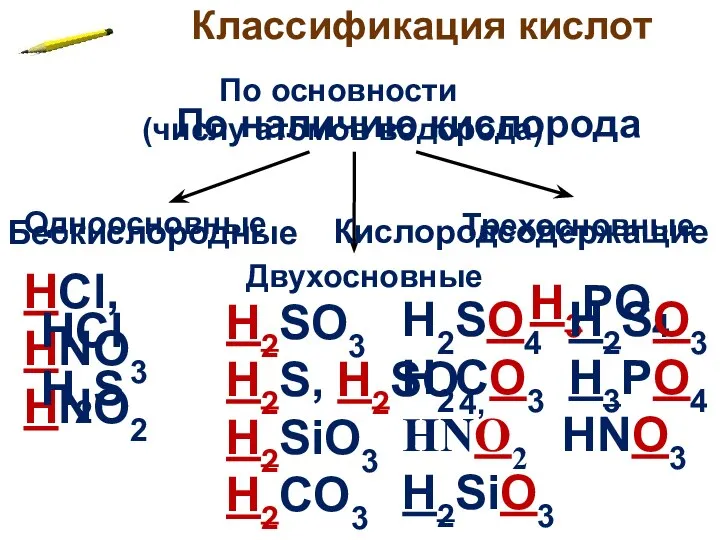
- 6. Классификация кислот По основности (числу атомов водорода) Одноосновные Двухосновные Трехосновные H2SO3 H2S, H2SO4, H2SiO3 H2CO3 HCl,
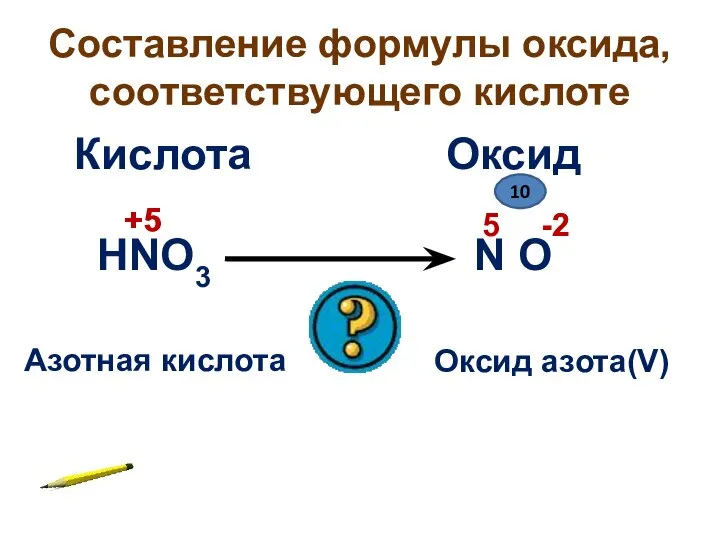
- 7. Составление формулы оксида, соответствующего кислоте HNO3 Кислота Оксид N O Азотная кислота Оксид азота(V) +5 -2
- 8. Техника безопасности Помните, что любое вещество может быть опасным, если обращаться с ним неправильно Никогда не
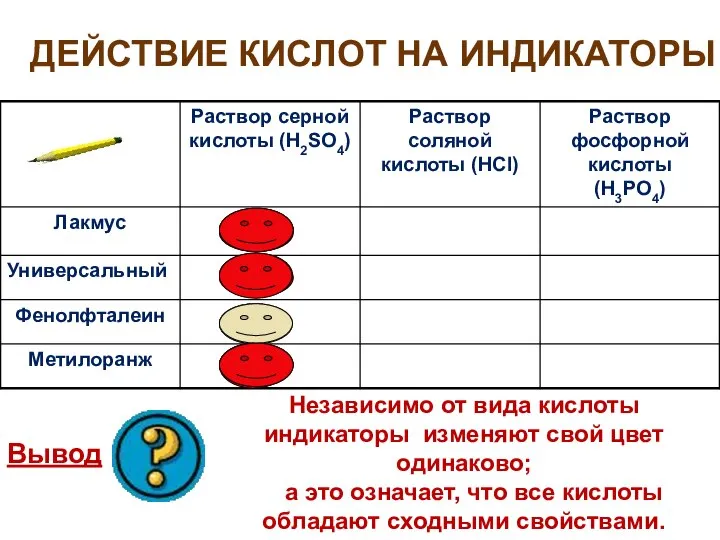
- 9. ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ Вывод Независимо от вида кислоты индикаторы изменяют свой цвет одинаково; а это
- 10. Это прозвище недаром У красивого цветка: Капля сочного нектара И душиста и сладка От простуды излечиться
- 11. Причины образования кислотных дождей КИСЛОТНЫЕ ОСАДКИ, дождь, снег или дождь со снегом, имеющие повышенную кислотность. Кислотные
- 12. Кислотные осадки разрушают сооружения из мрамора и известняка. Исторические памятники Греции и Рима, простояв тысячелетия, за
- 13. Кислоты в нашей жизни Есть в муравьях и крапиве невинная, С пользой для нас – кислота
- 14. Какую пользу приносят кислоты? H2SO4
- 15. Определить кислоту, щелочь и воду, среди выданных вам растворов веществ.
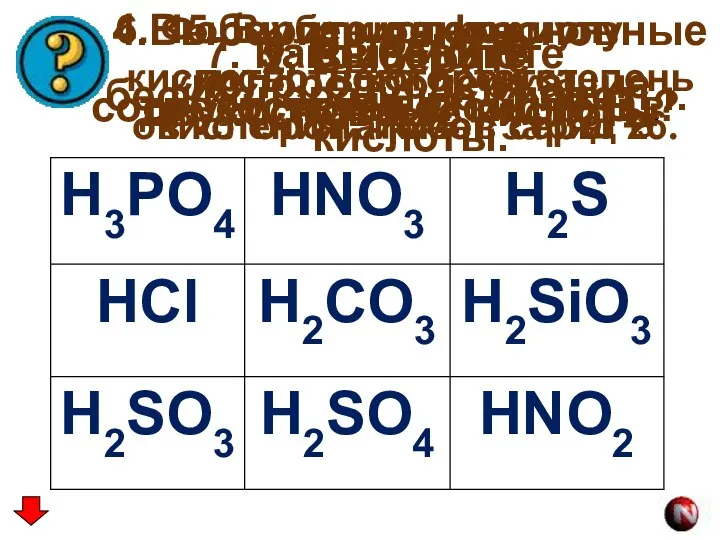
- 16. 1. Выберите бескислородные кислоты. 2. Выберите двухосновные кислоты. 3. Выберите трехосновные кислоты. 4.Выберите одноосновные кислородсодержащие кислоты.
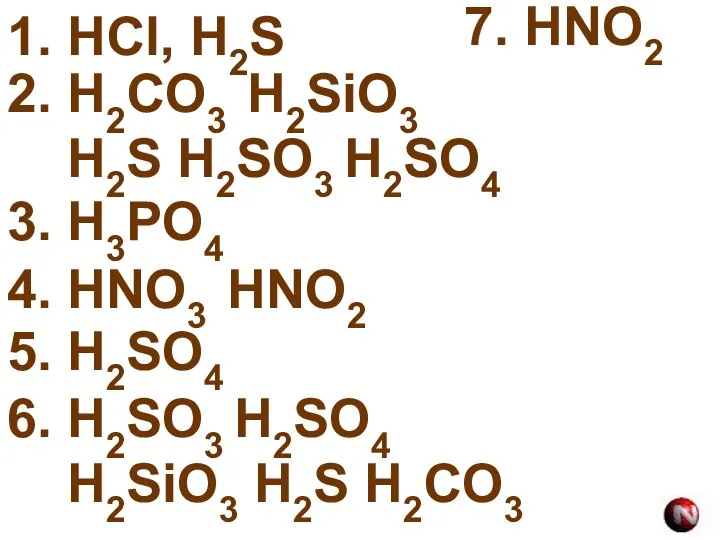
- 17. 1. HCl, H2S 2. H2CO3 H2SiO3 H2S H2SO3 H2SO4 3. H3PO4 4. HNO3 HNO2 5. H2SO4
- 18. Синквейн 1 строка – имя существительное 2 строка – два прилагательных 3 строка – три глагола
- 20. Скачать презентацию










 Модель Томпсона. Модель Резерфорда
Модель Томпсона. Модель Резерфорда Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Драгоценные камни
Драгоценные камни Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Тест- тренажер по теме: Основные классы неорганических веществ Оксиды
Тест- тренажер по теме: Основные классы неорганических веществ Оксиды Физика полимеров Ч1
Физика полимеров Ч1 Статистика в аналитической химии
Статистика в аналитической химии Галогены
Галогены Коррозия металлов
Коррозия металлов Углеводороды. Характеристика
Углеводороды. Характеристика Основания как электролиты
Основания как электролиты Ковалентная связь
Ковалентная связь Алкены. Физические и химические свойства
Алкены. Физические и химические свойства Классификация органических соединений
Классификация органических соединений Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Ортофосфорная кислота
Ортофосфорная кислота Модель Андерсона
Модель Андерсона Газовые законы
Газовые законы Аллотропные модификации
Аллотропные модификации Свойства оксидов. Тест с подсказками. 8 класс
Свойства оксидов. Тест с подсказками. 8 класс Пищевые добавки: вред и польза
Пищевые добавки: вред и польза Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Природный и попутный газы, их состав и использование
Природный и попутный газы, их состав и использование Исследование молока
Исследование молока Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Особенности органических веществ
Особенности органических веществ