Слайд 2Д.И.Менделеев (1834 – 1907 г.)
Русский учёный-энциклопедист: химик, физикохимик, физик, метролог, экономист, технолог,

геолог, метеоролог, нефтяник, педагог, преподаватель, воздухоплаватель, приборостроитель. Профессор Императорского Санкт-Петербургского университета; член-корреспондент (по разряду «физический») Императорской Санкт-Петербургской Академии наук. Среди самых известных открытий — периодический закон химических элементов, один из фундаментальных законов мироздания, неотъемлемый для всего естествознания. Автор классического труда «Основы химии».
Слайд 3Как все начиналось…
Выдающийся шведский химик Берцелиус разделил все элементы на металлы

и неметаллы на основе различий в свойствах, образованных ими простых веществ и соединений. Он определил, что металлы соответствуют основные оксиды и основания, а неметаллам – кислотные оксиды и кислоты.
Слайд 4Триады Деберейнера (1816 г.)
Немецкий химик И.В. Деберейнер разделил элементы по три на

основе сходства в свойствах образуемых веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу среднего элемента, была равна среднему арифметическому двух крайних. Пример триад:
Li Ca Cl S Mn
Na Sr Br Se Sr
K Ba I Te Fe
Слайд 5Спираль Шанкуртуа (1862 г.)
Профессор парижской высшей Li F
школы Шанкуртуа предложил

располагать элементы по спирали Na Cl
образующей цилиндр в
порядке возрастания их атомных K Br
масс и указал, что в этом случае
можно заметить сходство свойств Rb I
образуемых элементами веществ,
если они попадают на одну и ту же
вертикальную линию цилиндра,
располагаясь один под другим, например:
Слайд 6Классификация Мейера (1864 г.)
Немецкий исследователь Л. Мейер расположил химические элементы также

в порядке увеличения их атомных масс.
Слайд 7Раздумья днем и ночью…
До Д.И. Менделеева было предпринято более 50 попыток классифицировать

химические элементы. Большинство учёных пытались выявить связь между химическими свойствами и их соединений и атомной массой.
Слайд 817 февраля 1869 года
Статья Менделеева "Опыт системы элементов, основанной на их атомном

весе и химическом сходстве" датирована "17 февраля 1869 года" (это по старому стилю).
Так был открыт Периодический закон, современная формулировка которого такова:
«Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов».
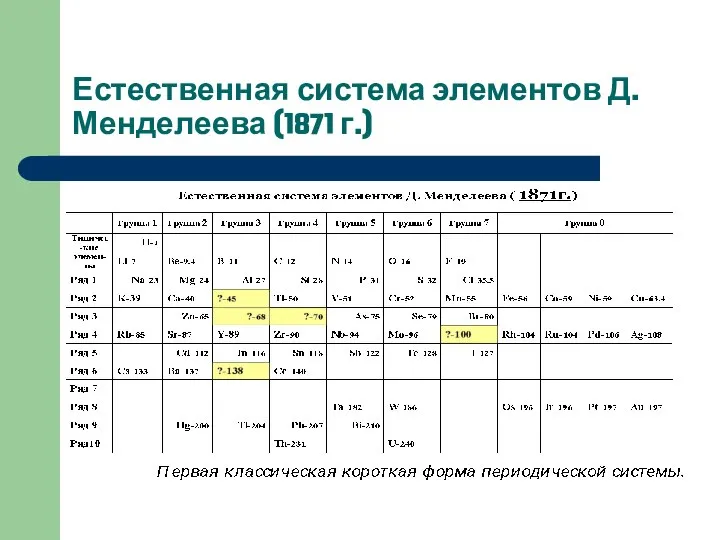
Слайд 9Естественная система элементов Д.Менделеева (1871 г.)
Слайд 11Периодический закон – основа современной химии.
Периодический закон является основным законом современности. Выводы,

сделанные Д.И.Менделеевым, находят свое подтверждение и в настоящее время. Происходят открытия новых химических элементов, которые находят свое место в Периодической системе.
Современные формулировки Периодического закона созвучны формулировкам Д.И.Менделеева. Периодическая система химических элементов, естественная система химических элементов, разработанная Д. И. Менделеевым на основе открытого им (1869) периодического закона.
Слайд 12Современная формулировка закона
Формулировка 1: Свойства химических элементов и образованных ими веществ находятся

в периодической зависимости от их относительных атомных масс.
Формулировка 2: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер
Формулировка 3: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от периодичности в изменении конфигураций внешних электронных слоёв атомов химических элементов.
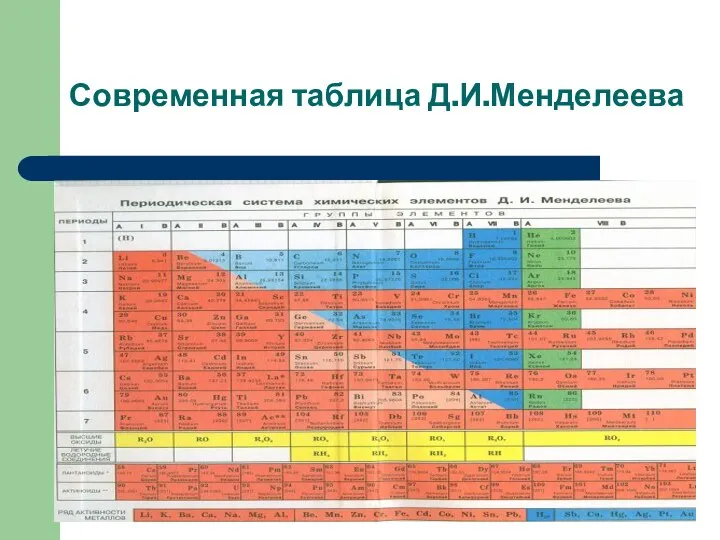
Слайд 13Современная таблица Д.И.Менделеева











 Технология производства и свойства химических волокон и тканей из них
Технология производства и свойства химических волокон и тканей из них Prezentatsia_k_uroku
Prezentatsia_k_uroku Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам 4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1) Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы 175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г.
175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г. Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии Определение формул органических веществ
Определение формул органических веществ Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11
Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11 Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Избыток, недостаток. Решение задач
Избыток, недостаток. Решение задач Амфотерные гидроксиды
Амфотерные гидроксиды Получение и применение алкадиенов
Получение и применение алкадиенов Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 Химическая кинетика. Лекция 4
Химическая кинетика. Лекция 4 Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства Атомные спектры
Атомные спектры Каучуки, их история и виды использования
Каучуки, их история и виды использования Особенности ковалентной связи
Особенности ковалентной связи Металлическая химическая связь
Металлическая химическая связь Химические свойства кислот
Химические свойства кислот Техника безопасности на уроках химии
Техника безопасности на уроках химии Ионообменные материалы для сорбции биологически активных веществ
Ионообменные материалы для сорбции биологически активных веществ Nevarne snovi
Nevarne snovi Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха