Слайд 2РЕАКЦИИ С УЧАСТИЕМ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Подчиняются тем же законам (закон сохранения массы и

энергии,
закон действующих масс и др.)
И проявляют те же закономерности (стехиометрические, энергетические), что и реакции неорганические
Слайд 3ОРГАНИЧЕСКИЕ РЕАКЦИИ ПРИНЯТО КЛАССИФИЦИРОВАТЬ
по механизмам протекания
Под механизмом реакции понимают последовательность

отдельных стадий протекания реакций с указанием промежуточных частиц, образующихся на каждой из этих стадий.
по направлению и конечным продуктам реакции:
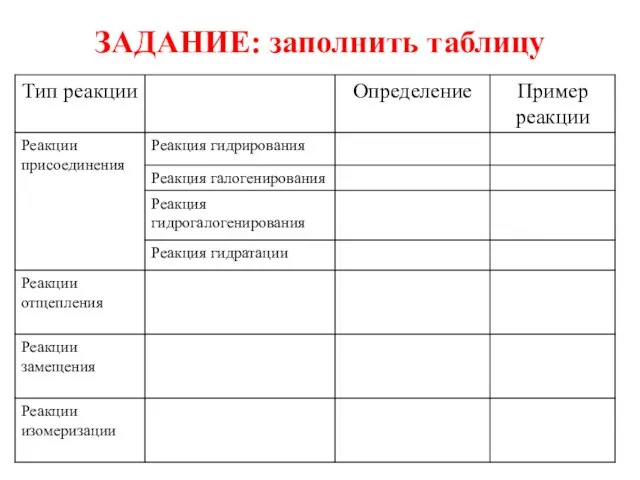
Присоединения
Отщепления (Элиминирования)
Замещения
Перегруппировки (Изомеризации)
Окисления и восстановления
Слайд 4По механизму реакции:
Гомолитические (радикальные) реакции R – это реакции, идущие с образованием

радикалов (частиц с неспаренным электроном).
А : В → А• + В•
А•; В• - R (радикалы)
Радикальные реакции протекают в газовой фазе или в неполярных растворителях в жестких условиях: высокая t, hν
Слайд 5По механизму реакции :
2. Гетеролитические (ионные или электрофильно-нуклеофильные) реакции – это реакции,

происходящие без разрыва электронных пар; оба электрона переходят на орбиталь одного из атомов с образованием аниона.
А : В → А+ + :В-
А+ - электрофильный реагент (электрофил)
:В- - нуклеофильный реагент (нуклеофил)
Ионные реакции протекают в полярных растворителях и требуют умеренной температуры, иногда катализатора.
Слайд 6По направлению и конечному продукту реакции:
Реакции замещения S - реакции, в результате

которых происходит замена атома или группы атомов на другой атом или группу атомов.
А-В + С → А-С + В
Например: галогенирование алканов
CH4 + Cl2 hν→ CH3Cl + HCl
Слайд 7По направлению и конечному продукту реакции:
2. Реакции присоединения А – реакции, в

результате которых происходит введение атома или группы атомов молекулу непредельного соединения, что сопровождается разрывом π-связи. При этом двойные связи превращаются в одинарные, а тройные – в двойные:
С = С + А – В → А – С – С – В
а) Галогенирование (присоединение галогенов)
CH2 = CH2 + Cl2 → Cl – CH2 – CH2 – Cl
Слайд 8 б) гидрирование (присоединение водорода):
CH2 = CH2 + H2 → CH3 – CH3

в) гидрогалогенирование (присоединение галогеноводородов):
CH2 = CH2 + HCl → CH3 – CH2 - Cl
г) гидратация (присоединение воды):
CH2 = CH2 + H – OH → CH3 – CH2 - OH
д) полимеризация
nCH2 = CH2 → [- CH2 – CH2 - ]n
Слайд 9 3. Реакции отщепления (элиминирования) - реакции, в результате которых происходит отщепление атомов

или группы атомов от органической молекулы с образованием кратный связей:
А – С – С – В → АВ + С = С
а) дегидрирование
CH3 – CH3 t, Ni→ CH2 = CH2 + H2
б) дегалогенирование
CH2Cl – CH2Cl + Zn t→ CH2 = CH2 + ZnCl2
в) дегидрогалогенирование
CH2Cl–CH3+NaOНcпирт.рр→CH2=CH2+NaCl+H2O
Слайд 10 г) дегидратация
CH2OH – CH3 t→ CH2 = CH2 + H2O
д) деполимеризация -

разрушение молекул полимера до исходных молекул
[- CH2 – CH2 - ]n t, кат.→ nCH2 = CH2
е) крекинг - термическое разложение молекул
C4H10 t→ C2H4 + C2H6
Слайд 11 4. Реакции перегруппировки (изомеризации) - реакции, в результате которых происходит перегруппировка атома

или группы атомов в молекуле (происходит перемещение атомов или группы атомов от одного фрагмента молекулы к другому без изменения их формулы).
X – A – B → A – B – X
CH3 – CH2 – CH2 – CH3 AlCl3, t→ CH3 – CH (CH3) – CH3
Слайд 12ВЫВОДЫ:
Органические реакции подчиняются общим законам и общим закономерностям их протекания.
Они

имеют общие для всех реакций признаки, но имеют и свои характерные особенности.
По механизму протекания реакции делятся на свободнорадикальные и ионные.
По направлению и конечному результату превращения: замещения, присоединения, отщепления, изомеризации, окисления и восстановления











 MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Lecture4-5
Lecture4-5 Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Получение и химические свойства оксидов
Получение и химические свойства оксидов Висмут
Висмут Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом
Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом Классификация углеводородов
Классификация углеводородов Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Химия и производство
Химия и производство Хладостойкие неметаллические материалы
Хладостойкие неметаллические материалы Соли
Соли Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов кинетика (1)
кинетика (1) Якісні реакції органічних речовин
Якісні реакції органічних речовин Термохимические уравнения
Термохимические уравнения Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Основные понятия и законы химии
Основные понятия и законы химии Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення
Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення Классификация неорганических веществ
Классификация неорганических веществ Диссоциация кислот
Диссоциация кислот Круговорот азота в природе
Круговорот азота в природе Магний
Магний Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Электролиз
Электролиз Металлы побочных подгрупп
Металлы побочных подгрупп