Содержание
- 2. СТРОЕНИЕ АТОМА ФОСФОРА
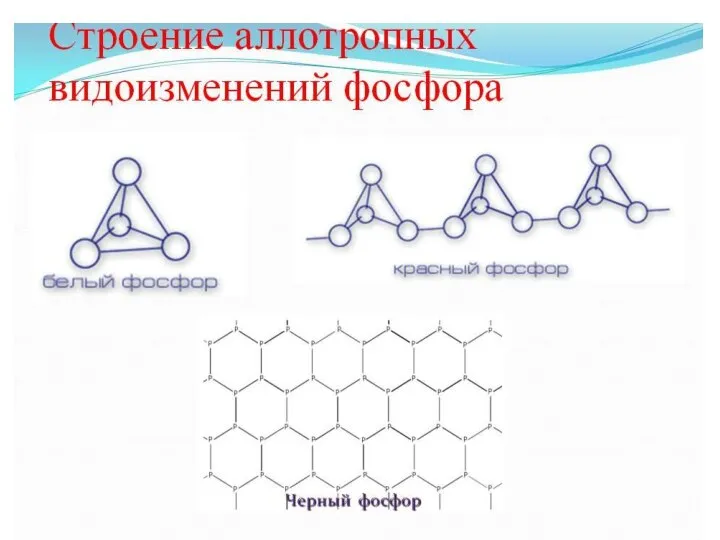
- 3. АЛЛОТРОПИЯ ФОСФОРА Аллотропия (от греческого «tropos» — признак) — это процесс, при котором один химический элемент
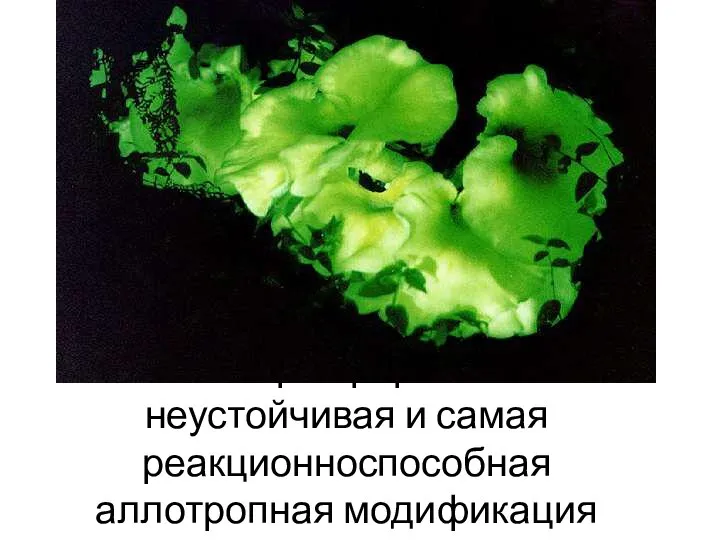
- 4. Белый фосфор – очень неустойчивая и самая реакционноспособная аллотропная модификация фосфора.
- 5. При обычных условиях красный фосфор устойчив.
- 6. Гораздо реже встречается черный фосфор.
- 8. Свечение белого фосфора в темноте Фосфор был открыт впервые гамбургским алхимиком Брандом в 1669 году. Сначала
- 9. ПОЛУЧЕНИЕ ФОСФОРА Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при
- 10. ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
- 11. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в
- 12. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №2. Осуществите превращения по схеме: P →Ca3P2 → PH3 → P2O5 Для первой
- 13. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №3. Осуществите превращения по схеме: Ca3(PO4)2 → P →P2O5 №4. расставьте коэффициенты методом
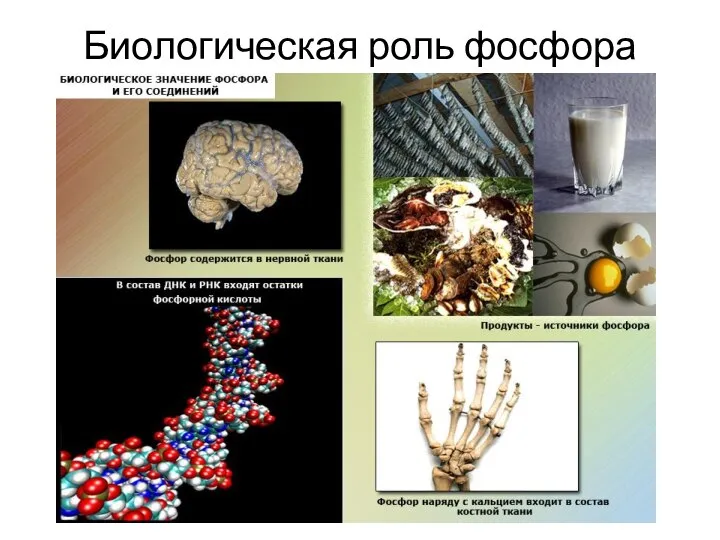
- 14. Биологическая роль фосфора
- 15. ТОКСИКОЛОГИЯ ФОСФОРА Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом
- 17. Скачать презентацию











 Приемы разделения мембранных липидов на классы
Приемы разделения мембранных липидов на классы Ионные уравнения
Ионные уравнения Неидеальные растворы
Неидеальные растворы Сплавы металлов
Сплавы металлов Основы молекулярно-кинетической теории
Основы молекулярно-кинетической теории Основы общей химии
Основы общей химии Коррозия металлов
Коррозия металлов Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Презентация Щелочные металлы
Презентация Щелочные металлы Железо
Железо Электрический ток в металлах
Электрический ток в металлах Презентация на тему Важнейшие соединения серы
Презентация на тему Важнейшие соединения серы  Титриметрический анализ
Титриметрический анализ Медь и ее сплавы
Медь и ее сплавы Возможности пропедевтического курса химии
Возможности пропедевтического курса химии Удивительная соль
Удивительная соль Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу ОВР в гетерогенных системах
ОВР в гетерогенных системах Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Полезные ископаемые
Полезные ископаемые Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Основные подходы к формированию и развитию социальных компетенций на уроках химии
Основные подходы к формированию и развитию социальных компетенций на уроках химии Плотность вещества
Плотность вещества Презентация на тему Степень окисления 8 класс
Презентация на тему Степень окисления 8 класс  Структура к свойства веществ
Структура к свойства веществ Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Алканы
Алканы