Содержание
- 2. Планетарная модель атома Резерфорда Планетарная модель атома калия В 1911 году в Кембридже, близ Лондона, английский
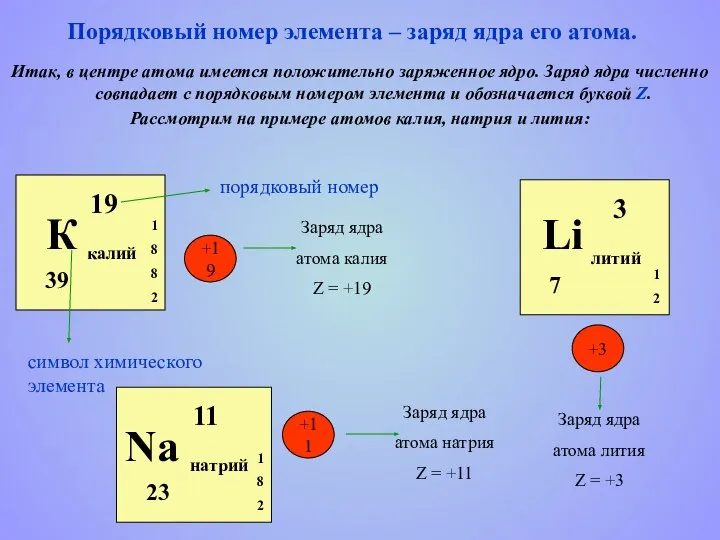
- 3. Итак, в центре атома имеется положительно заряженное ядро. Заряд ядра численно совпадает с порядковым номером элемента
- 4. Задание 1. а). По периодической системе химических элементов найдите заряды ядер атомов Al, P, Br, Cl,
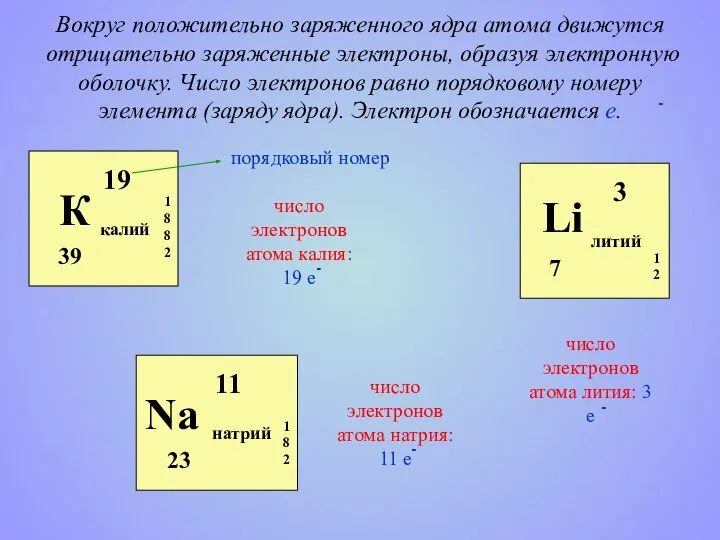
- 5. Вокруг положительно заряженного ядра атома движутся отрицательно заряженные электроны, образуя электронную оболочку. Число электронов равно порядковому
- 6. Задание 2. а). По периодической системе химических элементов найдите число электронов атомов Al, P, Br, Cl,
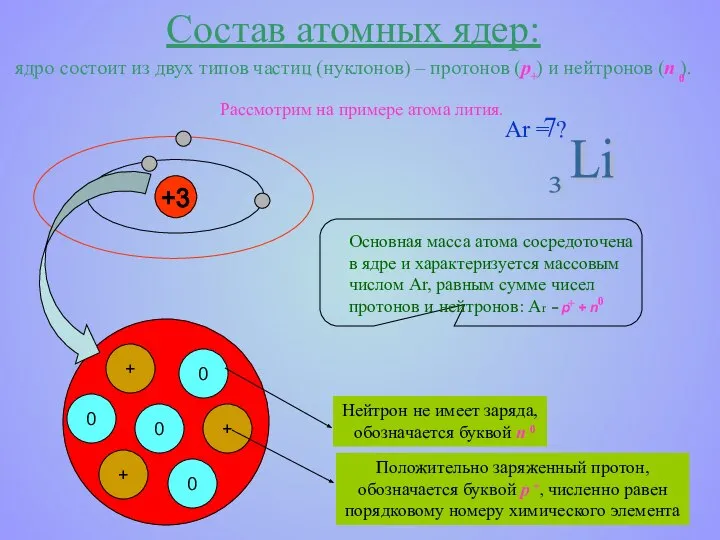
- 7. Состав атомных ядер: ядро состоит из двух типов частиц (нуклонов) – протонов (p ) и нейтронов
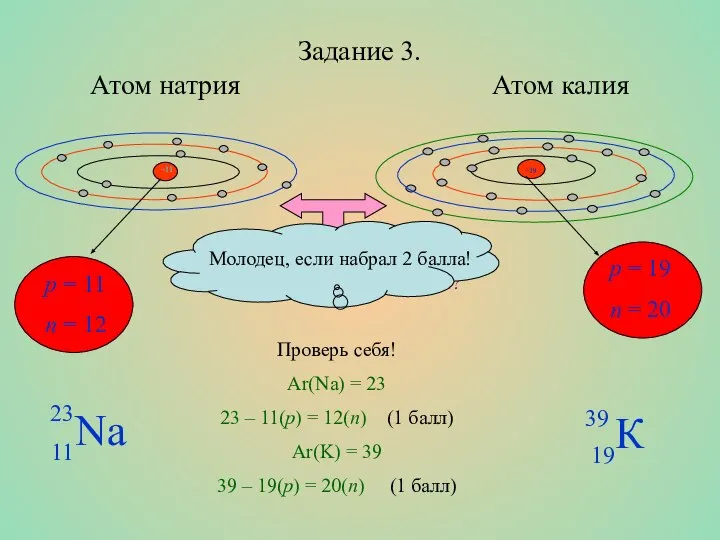
- 8. Задание 3. Атом натрия Атом калия p = 11 n = 12 p = 19 n
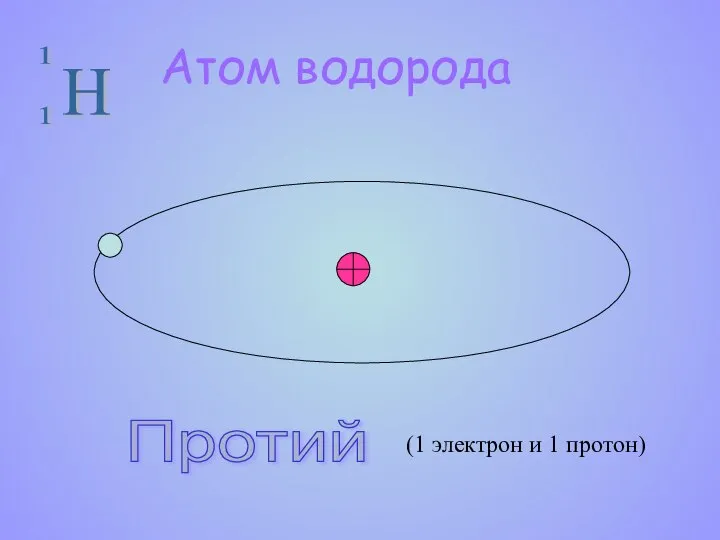
- 9. Атом водорода Протий (1 электрон и 1 протон)
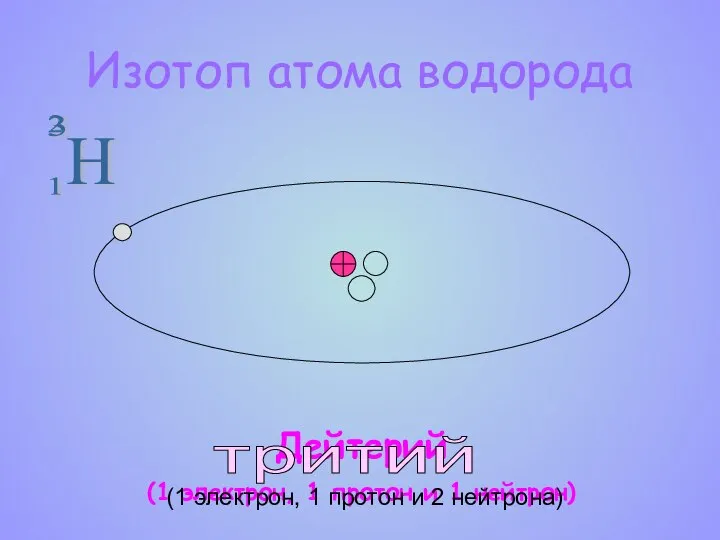
- 10. H 2 1 Изотоп атома водорода Дейтерий (1 электрон, 1 протон и 1 нейтрон) 3 тритий
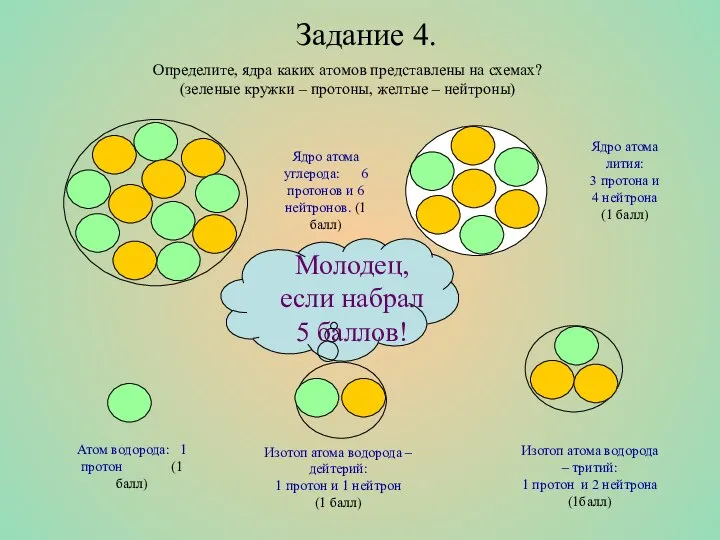
- 11. Задание 4. Определите, ядра каких атомов представлены на схемах? (зеленые кружки – протоны, желтые – нейтроны)
- 12. Планетарная модель атома лития по Резерфорду: Вокруг положительно заряженного ядра атома лития движутся отрицательно заряженные электроны,
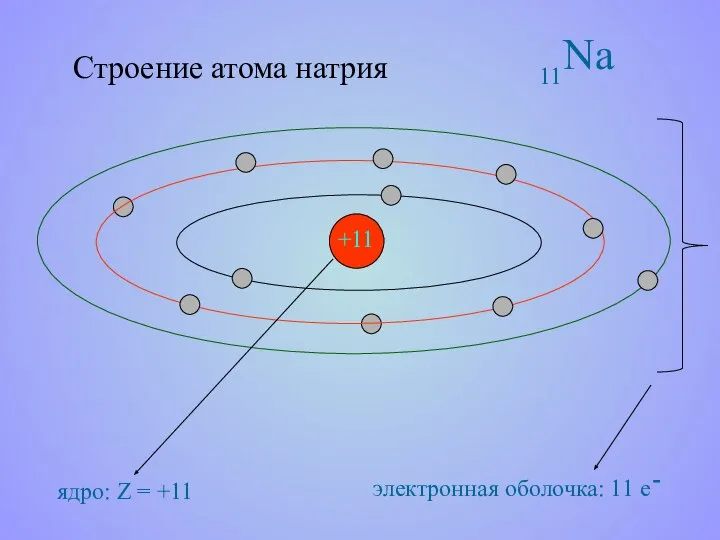
- 13. Строение атома натрия +11
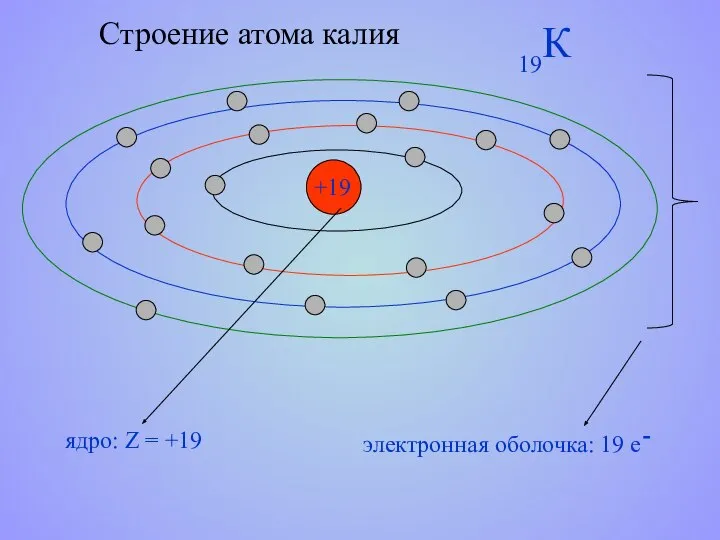
- 14. Строение атома калия +19
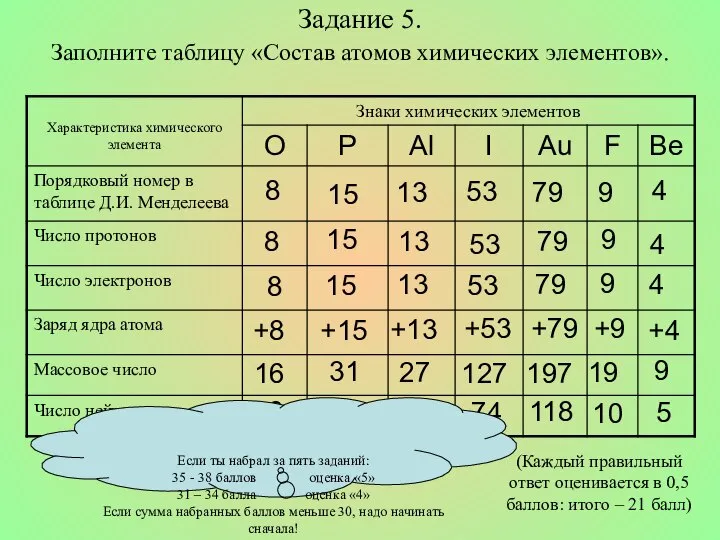
- 15. Задание 5. Заполните таблицу «Состав атомов химических элементов». (Каждый правильный ответ оценивается в 0,5 баллов: итого
- 17. Скачать презентацию




 Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Разбор задач
Разбор задач Презентация на тему Аминокислоты. История их открытия
Презентация на тему Аминокислоты. История их открытия  Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Химия природная и синтетическая: за и против
Химия природная и синтетическая: за и против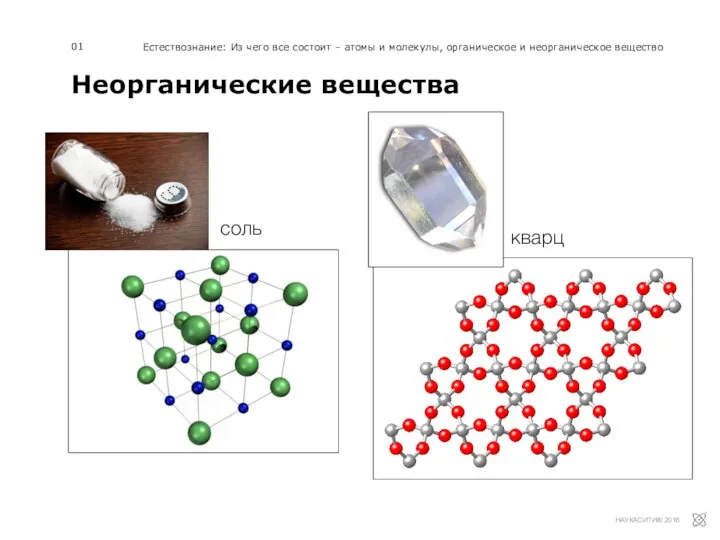 Неорганические вещества
Неорганические вещества Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Строение и физические свойства металлов
Строение и физические свойства металлов Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Методи визначення корозійної стійкості матеріалів (тема 11)
Методи визначення корозійної стійкості матеріалів (тема 11) Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды Железо
Железо Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Физические свойства воды.Перегонка. Растворимость веществ в воде
Физические свойства воды.Перегонка. Растворимость веществ в воде Введение в медицинскую химию: от молекулы к лекарству
Введение в медицинскую химию: от молекулы к лекарству Хлорорганические соединения
Хлорорганические соединения Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Судьба углеродного скелета аминокислот
Судьба углеродного скелета аминокислот Химия - неотъемлемая часть жизни
Химия - неотъемлемая часть жизни Электроны в кристаллах. Приложения зонной теории
Электроны в кристаллах. Приложения зонной теории Валентность химических элементов
Валентность химических элементов Окисли́тельно-восстанови́тельные реа́кции
Окисли́тельно-восстанови́тельные реа́кции Презентация на тему Оксиды углерода
Презентация на тему Оксиды углерода  Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Химия природная или синтетическая
Химия природная или синтетическая Соединения азота
Соединения азота Металлургия в химии
Металлургия в химии