Содержание
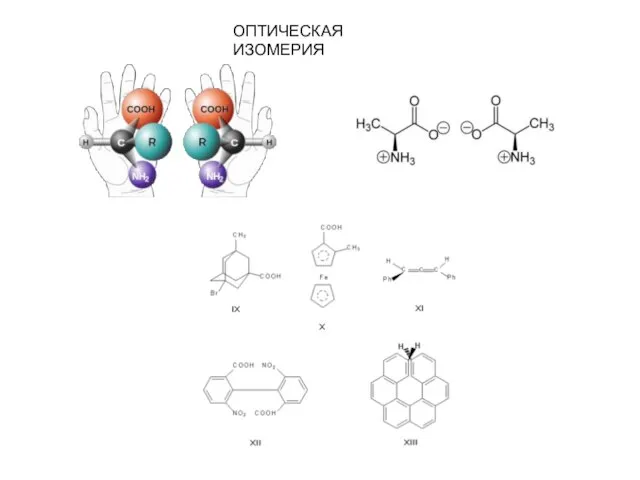
- 2. ОПТИЧЕСКАЯ ИЗОМЕРИЯ
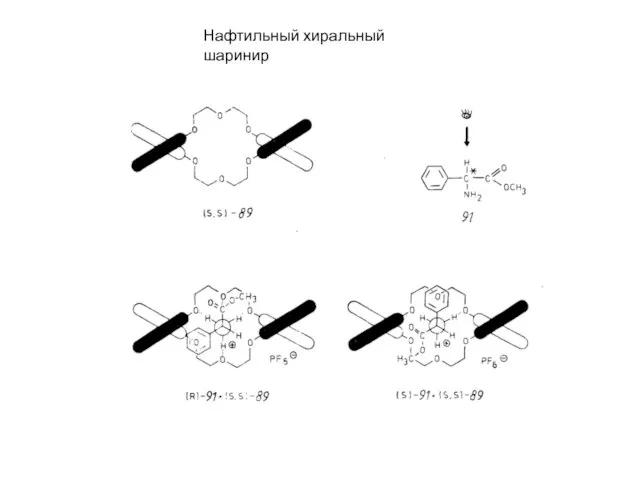
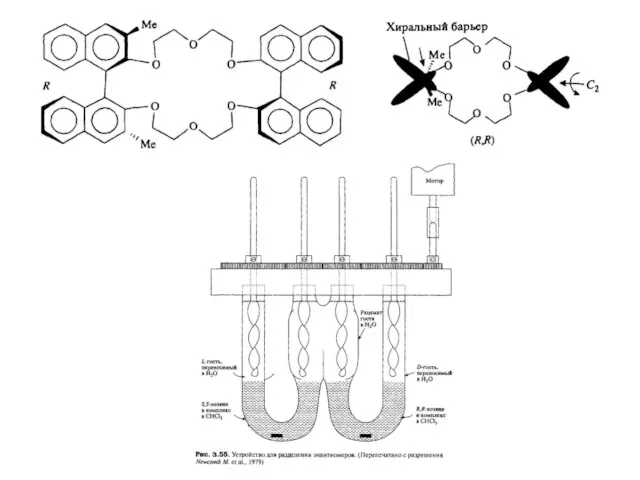
- 4. Нафтильный хиральный шаринир
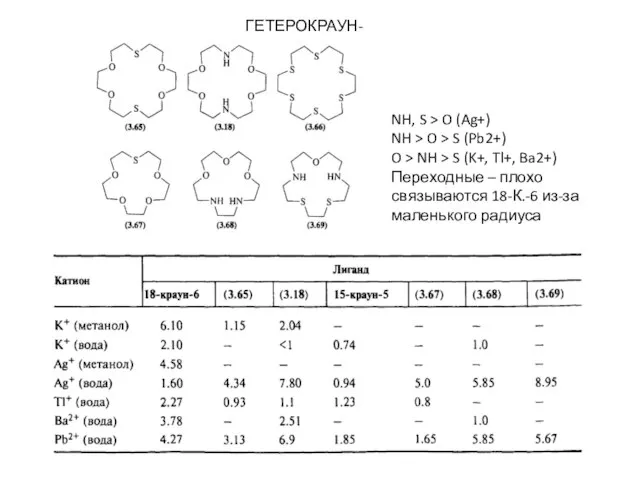
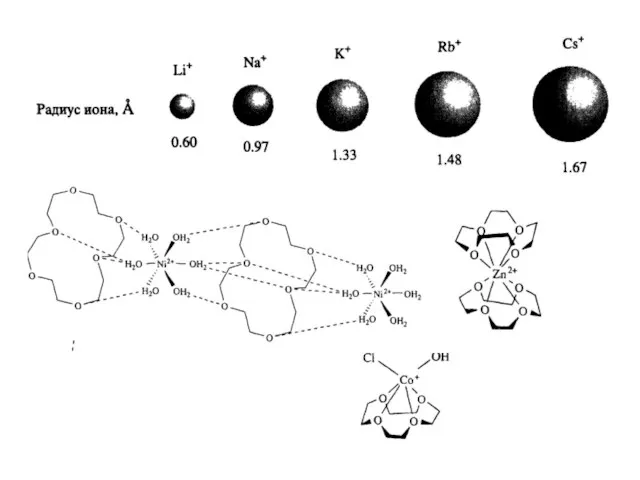
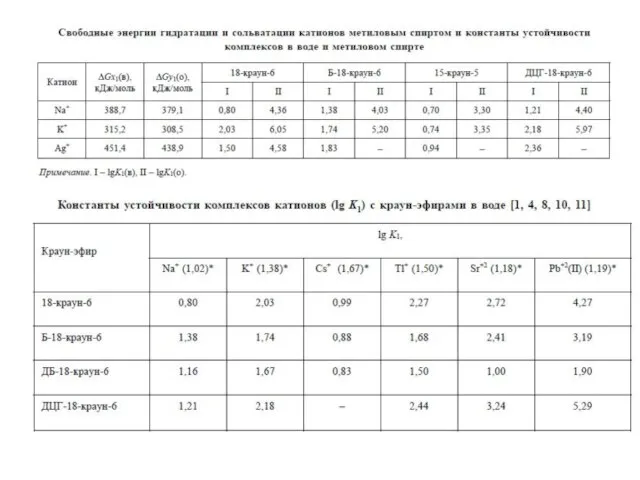
- 6. ГЕТЕРОКРАУН-ЭФИРЫ NH, S > O (Ag+) NH > O > S (Pb2+) O > NH >
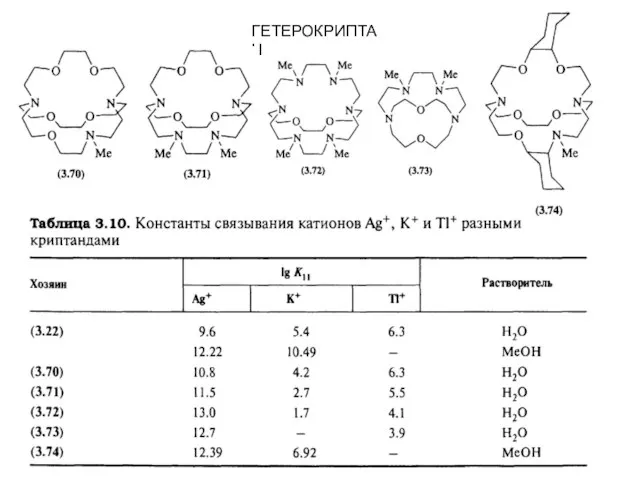
- 9. ГЕТЕРОКРИПТАНДЫ
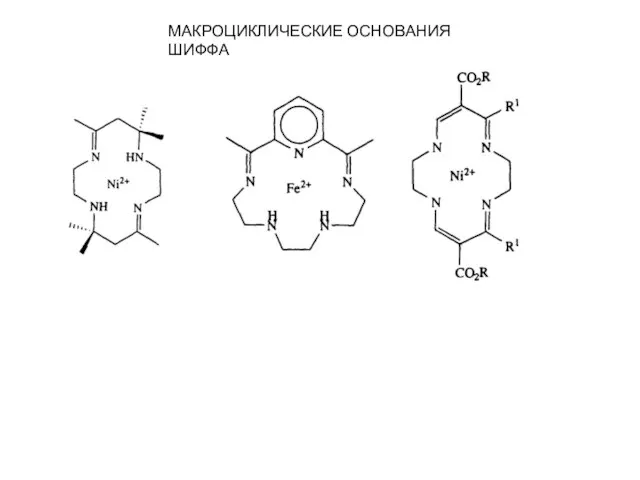
- 11. МАКРОЦИКЛИЧЕСКИЕ ОСНОВАНИЯ ШИФФА
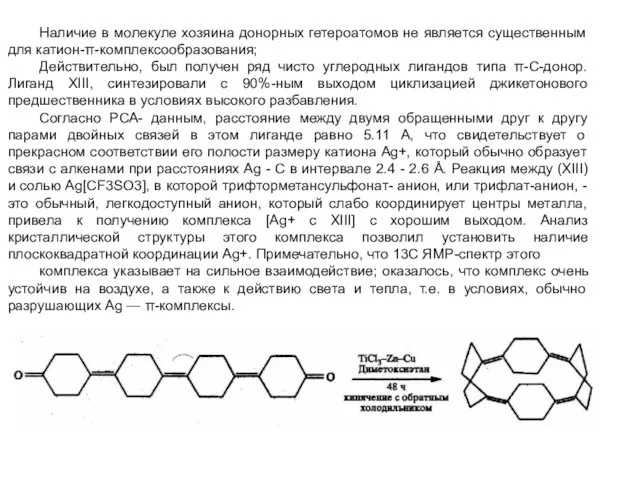
- 12. Наличие в молекуле хозяина донорных гетероатомов не является существенным для катион-π-комплексообразования; Действительно, был получен ряд чисто
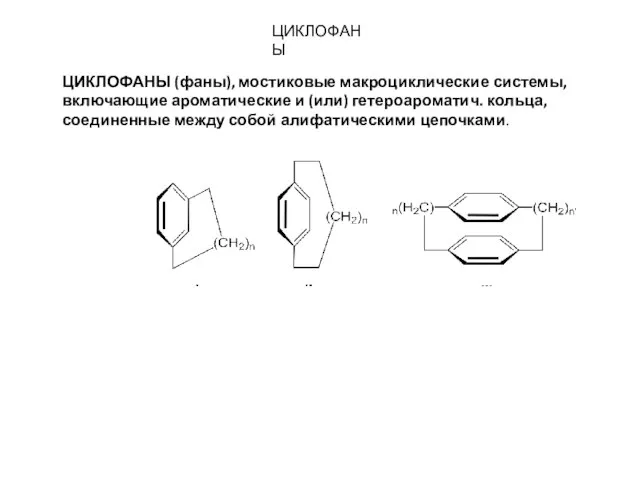
- 13. ЦИКЛОФАНЫ ЦИКЛОФАНЫ (фаны), мостиковые макроциклические системы, включающие ароматические и (или) гетероароматич. кольца, соединенные между собой алифатическими
- 14. Первоначально циклофанами наз. системы, включающие бензольные кольца, связанные по пара- или мета-положениям полиметиленовыми цепочками (соед. I-VI).
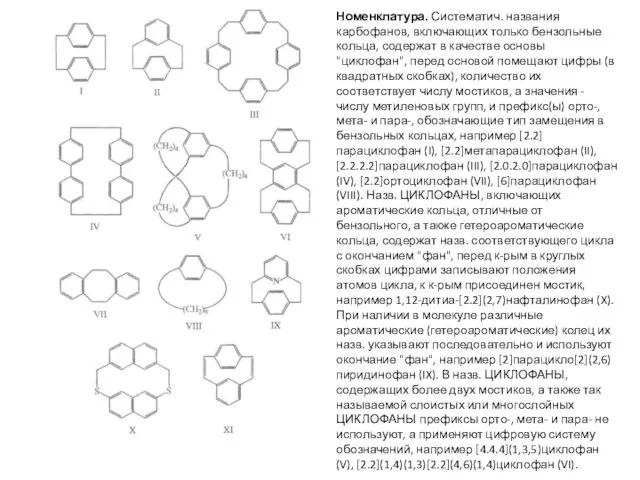
- 15. Номенклатура. Систематич. названия карбофанов, включающих только бензольные кольца, содержат в качестве основы "циклофан", перед основой помещают
- 16. Циклофаны получают из производных ароматич. и гетероароматич. соединений. Так, [2.2]парациклофан м. б. синтезирован из 4,4'-дибромметил-1,2-дифенилэтана по
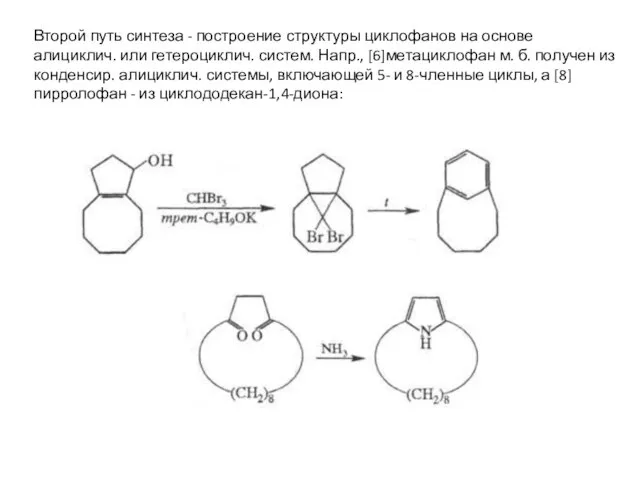
- 17. Второй путь синтеза - построение структуры циклофанов на основе алициклич. или гетероциклич. систем. Напр., [6]метациклофан м.
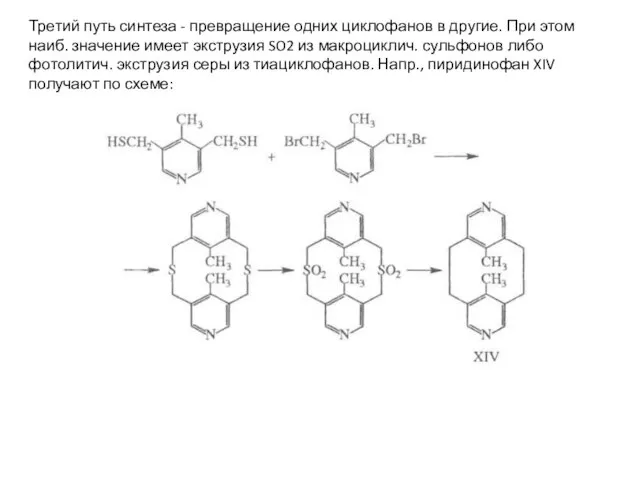
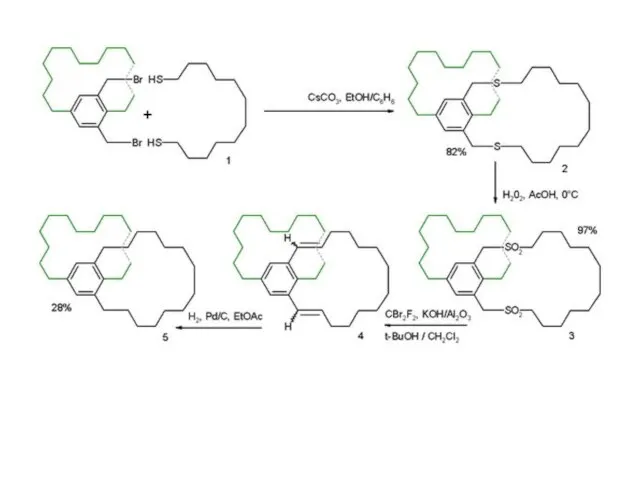
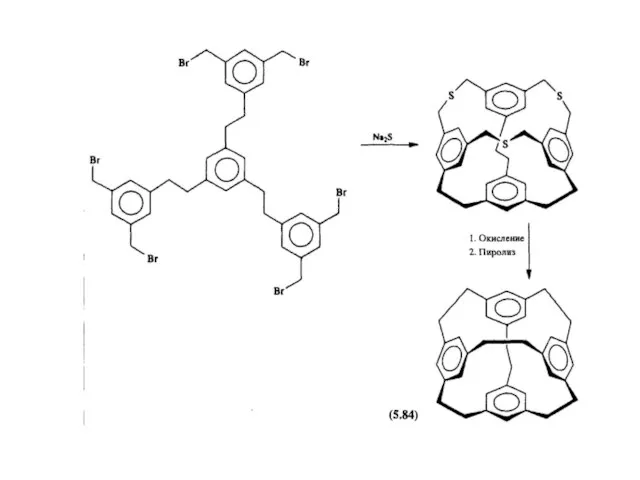
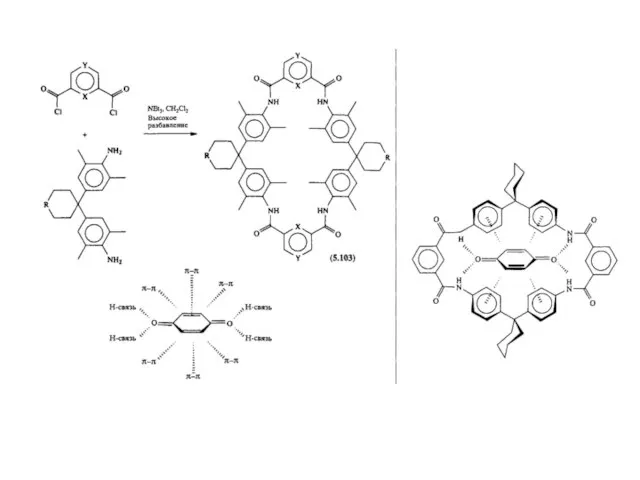
- 18. Третий путь синтеза - превращение одних циклофанов в другие. При этом наиб. значение имеет экструзия SO2
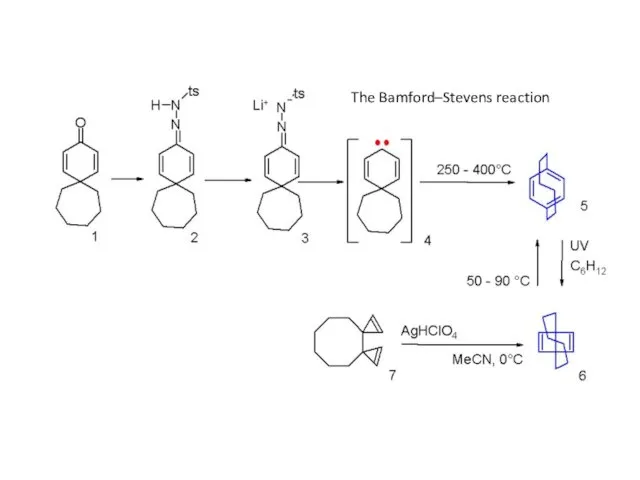
- 19. The Bamford–Stevens reaction
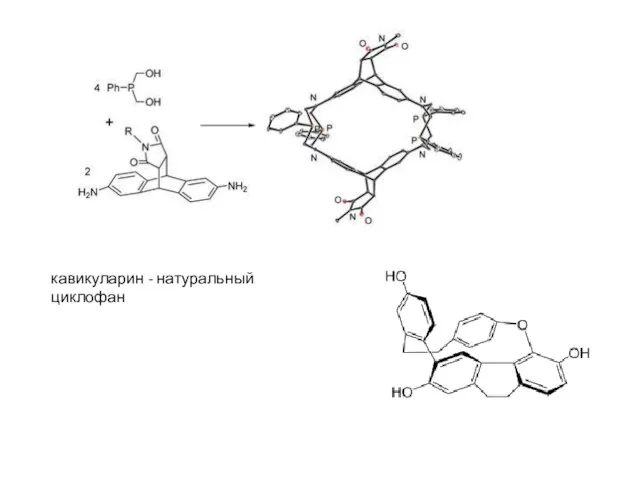
- 23. кавикуларин - натуральный циклофан
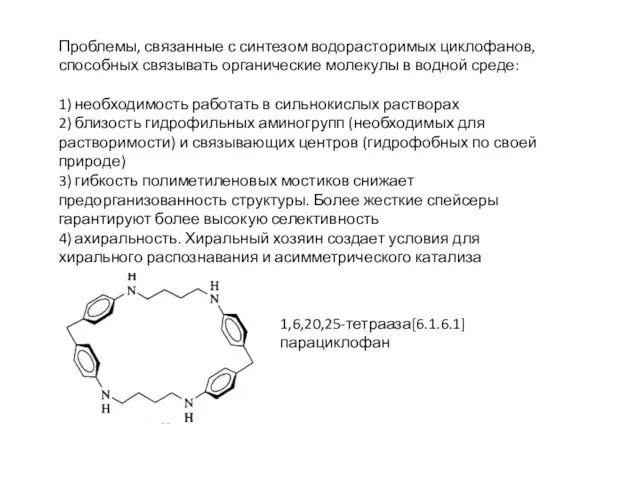
- 25. 1,6,20,25-тетрааза[6.1.6.1]парациклофан Одашима (1980) , растворим в воде при рН меньше 2.0.
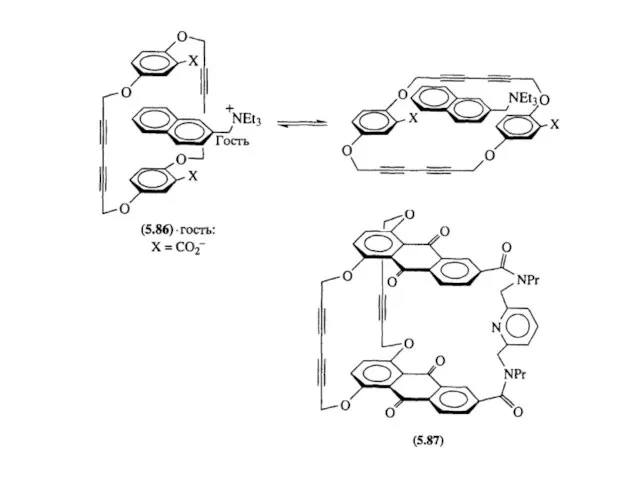
- 26. Проблемы, связанные с синтезом водорасторимых циклофанов, способных связывать органические молекулы в водной среде: 1) необходимость работать
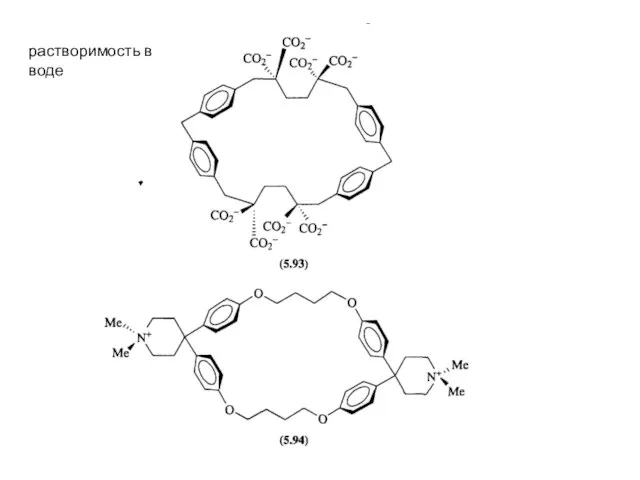
- 27. растворимость в воде
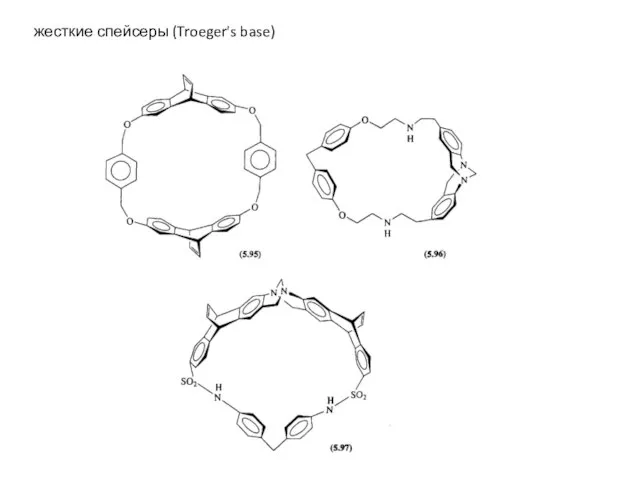
- 28. жесткие спейсеры (Troeger's base)
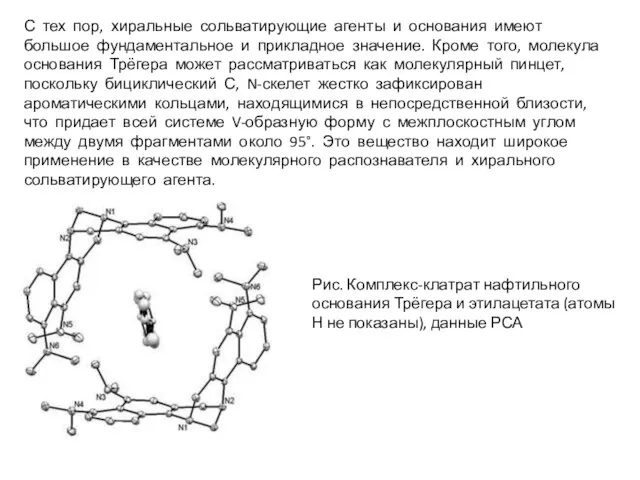
- 29. Отступление об основании Трёгера Основание Трегера (или 2,8-диметил-6H,12H-5,11-метанодибензо[b,f] [1, 5]диазоцин) было впервые синтезировано в 1887 году
- 30. С тех пор, хиральные сольватирующие агенты и основания имеют большое фундаментальное и прикладное значение. Кроме того,
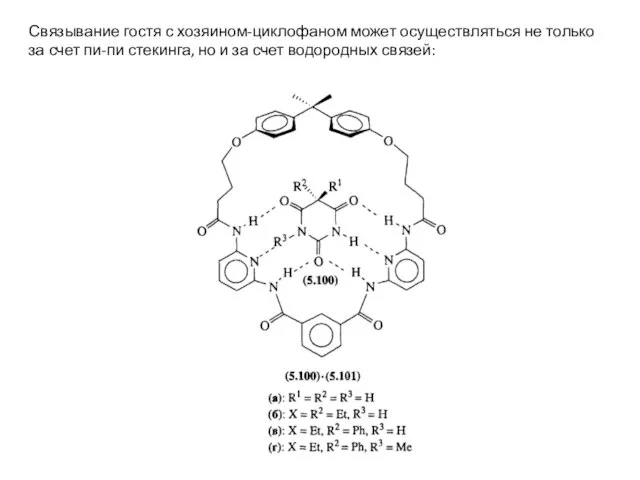
- 31. Связывание гостя с хозяином-циклофаном может осуществляться не только за счет пи-пи стекинга, но и за счет
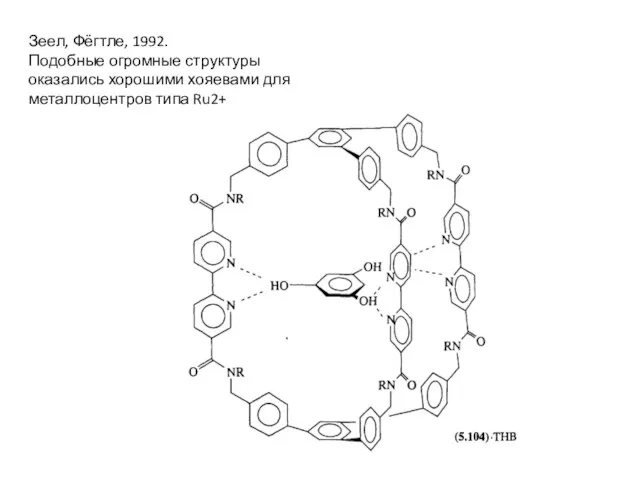
- 33. Зеел, Фёгтле, 1992. Подобные огромные структуры оказались хорошими хояевами для металлоцентров типа Ru2+
- 35. Скачать презентацию


![Циклофаны получают из производных ароматич. и гетероароматич. соединений. Так, [2.2]парациклофан м. б.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/894700/slide-15.jpg)
![1,6,20,25-тетрааза[6.1.6.1]парациклофан Одашима (1980) , растворим в воде при рН меньше 2.0.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/894700/slide-24.jpg)
![Отступление об основании Трёгера Основание Трегера (или 2,8-диметил-6H,12H-5,11-метанодибензо[b,f] [1, 5]диазоцин) было впервые](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/894700/slide-28.jpg)
 Презентация на тему Серная кислота
Презентация на тему Серная кислота  Углеводороды: классификация
Углеводороды: классификация Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Основания. Как называют основания?
Основания. Как называют основания? Создание раствора для ингибирования коррозии черных металлов и его утилизация на удобрения
Создание раствора для ингибирования коррозии черных металлов и его утилизация на удобрения Рідкі кристали
Рідкі кристали Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний Типы химических реакций
Типы химических реакций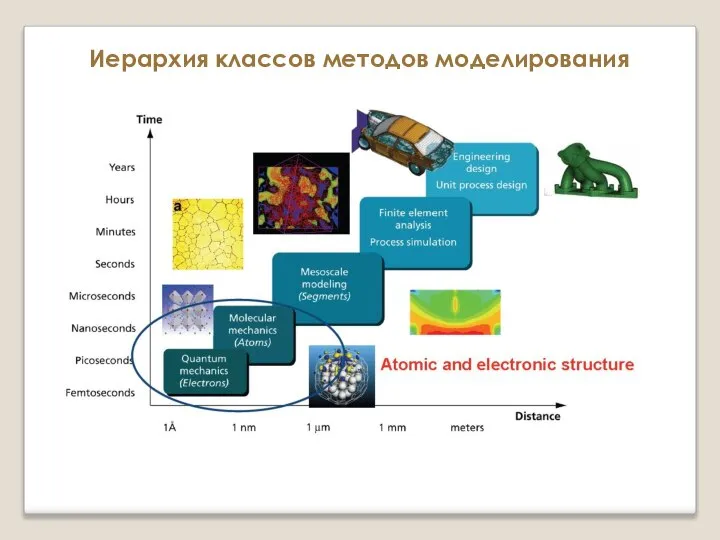 Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Исследование свойств многоатомных спиртов
Исследование свойств многоатомных спиртов Простые и сложные вещества. Основные классы неорганических веществ
Простые и сложные вещества. Основные классы неорганических веществ Влияние растворителей на скорость органических реакций. (Лекция 10)
Влияние растворителей на скорость органических реакций. (Лекция 10) Нефть
Нефть Кальций
Кальций Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Арены. Бензол
Арены. Бензол Фенолы: методы синтеза и химические свойства
Фенолы: методы синтеза и химические свойства Ліпіди і їх роль в життєдіяльності клітини
Ліпіди і їх роль в життєдіяльності клітини Ионная химическая связь
Ионная химическая связь Азот
Азот Триметилалюминий
Триметилалюминий Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Различные типы неорганических полимеров
Различные типы неорганических полимеров Кремень. Нахождение в природе
Кремень. Нахождение в природе Ферменты
Ферменты