Содержание
- 2. Предшественники Д. И. Менделеева 1. Й. Я. Берцелиус ( шведский учёный) классифицировал все элементы на металлы
- 3. Предшественники Д. И. Менделеева 2. И. В. Дёберейнер ( немецкий химик) в 1829 г. предпринял первую
- 4. Предшественники Д. И. Менделеева 3. А. Бегье де Шанкуртуа (профессор Парижской высшей школы) в 1862 г.
- 5. Предшественники Д. И. Менделеева 4. Д. Ньюлендс (английский учёный) в 1865 г. расположил элементы в порядке
- 6. Предшественники Д. И. Менделеева 5. Л. Мейер (немецкий химик) в 1864 г. расположил химические элементы в
- 7. Вывод Классификация химических элементов была не точной, не научной, не совершенной, так как за основу классификации
- 8. Тема: Периодический закон и Периодическая система химических элементов Д.И Менделеева
- 9. Д.И. Менделеев (1834 — 1907 гг.)
- 10. Биография Родился Д.И.Менделеев 27 января (6 февраля) 1834 г. в городе Тобольске.
- 11. Биография Мария Дмитриевна Менделеева (1793 - 1830), мать ученого Иван Павлович Менделеев (1783 - 1847), отец
- 12. Биография Д.И. Менделеев учился в Тобольской гимназии, а затем в Педагогическом институте в Петербурге. Охотно занимался
- 13. Биография В 1855 г. Д. И. Менделеев окончил институт с золотой медалью, получил диплом старшего учителя.
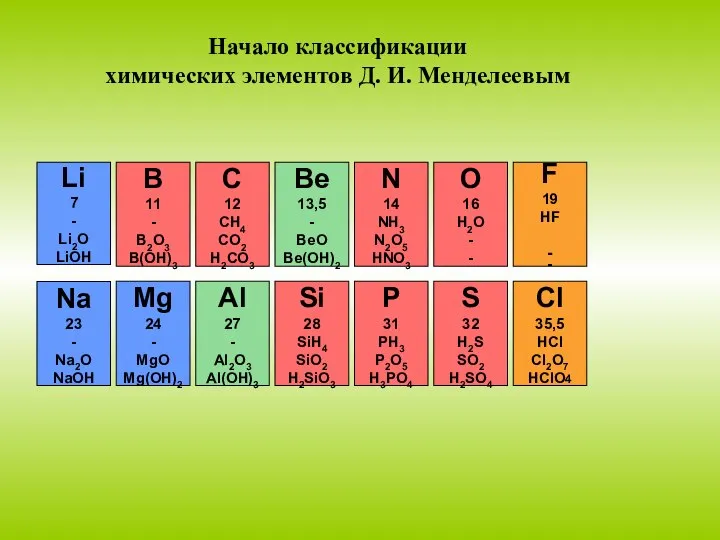
- 14. В основу работ по классификации химических элементов Д.И.Менделеева положены два признака: Величины атомных весов. Химические свойства.
- 15. C 12 CH4 CO2 H2CO3 - Символ элемента - Атомная масса элемента - Формула летучего соединения
- 16. Li 7 - Li2O LiOH B 11 - B2O3 B(OH)3 C 12 CH4 CO2 H2CO3 Be
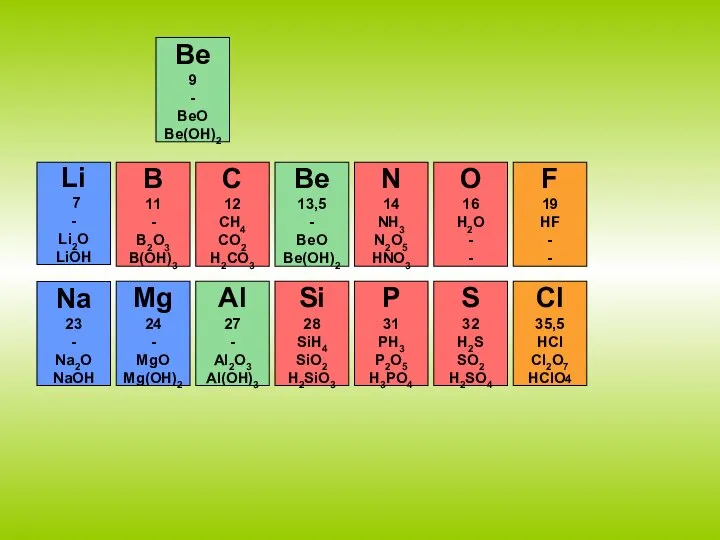
- 17. Li 7 - Li2O LiOH B 11 - B2O3 B(OH)3 C 12 CH4 CO2 H2CO3 Be
- 18. Na 23 - Na2O NaOH Mg 24 - MgO Mg(OH)2 Al 27 - Al2O3 Al(OH)3 Si
- 19. Li 7 - Li2O LiOH B 11 - B2O3 B(OH)3 C 12 CH4 CO2 H2CO3 N
- 20. Li 7 - Li2O LiOH B 11 - B2O3 B(OH)3 C 12 CH4 CO2 H2CO3 Na
- 21. Li 7 - Li2O LiOH B 11 - B2O3 B(OH)3 C 12 CH4 CO2 H2CO3 N
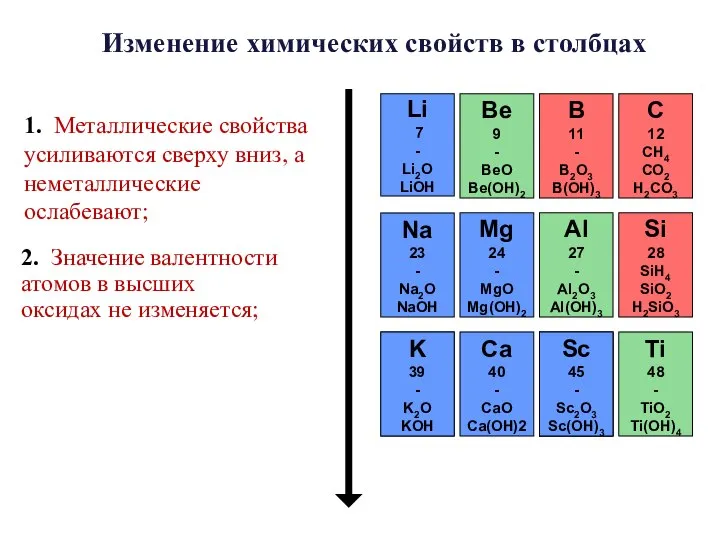
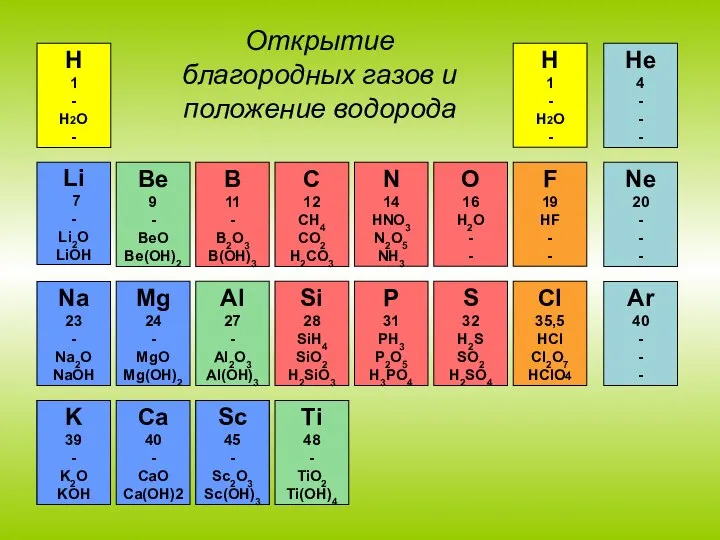
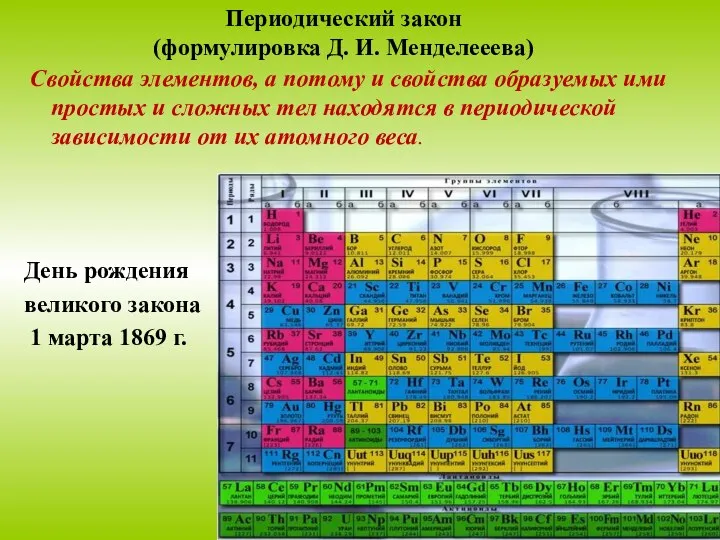
- 22. Периодический закон (формулировка Д. И. Менделееева) Свойства элементов, а потому и свойства образуемых ими простых и
- 24. Скачать презентацию
















 Особенности базового курса органической химии издательства «ОЛМА»
Особенности базового курса органической химии издательства «ОЛМА» Предмет органической химии. Теория химического строения органических веществ. 9 класс
Предмет органической химии. Теория химического строения органических веществ. 9 класс Блеск и сила волос с точки зрения химии
Блеск и сила волос с точки зрения химии Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы
Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы Классификация пластмасс. Свойства и применение пластмасс
Классификация пластмасс. Свойства и применение пластмасс Коррозия металлов
Коррозия металлов Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Щелочные металлы
Щелочные металлы Фармацевтическая химия субстанций. Лекция 5
Фармацевтическая химия субстанций. Лекция 5 Синтез олигомеров этиленгликоля и терефталевой кислоты
Синтез олигомеров этиленгликоля и терефталевой кислоты Презентация на тему Биологические действия радиации
Презентация на тему Биологические действия радиации  Химия элементов IVA группы
Химия элементов IVA группы Химические свойства воды
Химические свойства воды 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 Азотная кислота
Азотная кислота Реакции ионного обмена и условия их протекания
Реакции ионного обмена и условия их протекания proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Кислородосодержащие органические вещества
Кислородосодержащие органические вещества Соединения азота
Соединения азота Минеральные воды Старой Руссы
Минеральные воды Старой Руссы Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Карбоновые кислоты
Карбоновые кислоты Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Полимеры
Полимеры Кристаллические решетки
Кристаллические решетки Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Строение атома
Строение атома Тазалау. Тазалаудың мақсаты
Тазалау. Тазалаудың мақсаты