Содержание
- 2. 01.02.2013 Степень окисления +1 азот проявляет в соединении NH3 N2O3 N2O AlN Подготовка к ГИА
- 3. 01.02.2013 Иону N3- соответствует электронная формула: 1s22s22p63s23p6. 1s22s2 1s22s22p6 1s22s22p3 Подготовка к ГИА
- 4. 01.02.2013 В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления? NH3 и PCl5
- 5. 01.02.2013 Какую химическую формулу имеет соединение, в котором степени окисления элементов равны +5 и -2? NH3
- 6. 01.02.2013 Азот входит в главную подгруппу: IV группы V группы VI группы VII группы Подготовка к
- 7. 01.02.2013 Раствор аммиака в воде имеет среду? кислотную обычную нейтральную основную Подготовка к ГИА
- 8. 01.02.2013 Какой вид химической связи в аммиаке? ионная ковалентная полярная ковалентная неполярная металлическая Подготовка к ГИА
- 9. 01.02.2013 Аммиак горит в кислороде без катализатора с образованием: Азота Азотной кислоты Оксида азота (III) Оксида
- 10. 01.02.2013 Нашатырный спирт – это: Хлорид аммония Раствор аммиака в спирте Раствор аммиака в воде Медицинский
- 11. 01.02.2013 Азот при обычных условиях - … Тяжелый металл Газ без цвета и запаха Бесцветная маслянистая
- 12. 01.02.2013 Реакция между хлоридом аммония и гидроксидом кальция идет потому что… Выпадает осадок Образуется соль Выделяется
- 13. 01.02.2013 Аммиак горит в кислороде в присутствии катализатора с образованием: Азотной кислоты Оксида азота (III) Оксида
- 14. 01.02.2013 Газ выделяется при взаимодействии MgCl2 и Ba(MO3)2 Na2CO3 и CaCl2 NH4Cl и NaOH CuSO4 и
- 15. 01.02.2013 Раствор аммиака окрашивает фенолфталеин в ….. цвет? синий малиновый желтый не окрашивает Подготовка к ГИА
- 16. 01.02.2013 Аммиак –. газ без цвета, без запаха, не ядовит газ бурого цвета газ без цвета,
- 17. 01.02.2013 Число электронов в атоме азота 14 12 7 9 Подготовка к ГИА
- 18. 01.02.2013 Число энергетических уровней в атоме азота 5 4 3 2 Подготовка к ГИА
- 19. 01.02.2013 Верны ли следующие суждения о свойствах азота? А. В соединениях с водородом и металлами азот
- 20. 01.02.2013 Положительную степень окисления атом азота имеет в соединении NaNO3 Na3N NH3 NH4Cl Подготовка к ГИА
- 21. 01.02.2013 Сумма коэффициентов в уравнении реакции NH3 + O2 = NO + H2O равна 14 15
- 22. 01.02.2013 Качественная реакция на катион аммония сульфат анион бромид анион хлорид анион гидроксид анион Подготовка к
- 23. 01.02.2013 В схеме превращений NO-----X-------HNO3, веществом Х является NO2 NH3 N2O5 N2 Подготовка к ГИА
- 24. 01.02.2013 Высшая валентность азота равна I III V VII Подготовка к ГИА
- 25. 01.02.2013 Общая формула водородного соединения элементов VА группы HR H2R RH3 RH4 Подготовка к ГИА
- 26. 01.02.2013 Верны ли следующие суждения о свойствах азотной кислоты? А. Одноосновная, сильная, кислородосодержащая Б. Концентрированная кислота
- 28. Скачать презентацию

























 Кислоты
Кислоты Химия неметаллов: углерод, кремний
Химия неметаллов: углерод, кремний Альдегиды. Получение и применение. Общая формула альдегидов
Альдегиды. Получение и применение. Общая формула альдегидов Количество вещества
Количество вещества Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Метод валентных связей
Метод валентных связей Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Peek. Сферы применения
Peek. Сферы применения Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции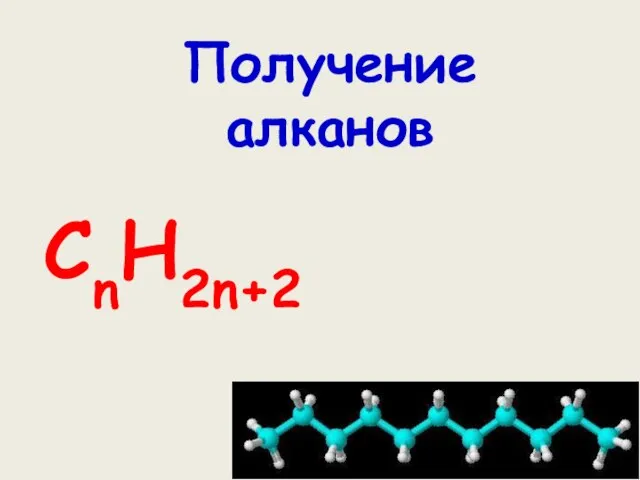 Получение алканов
Получение алканов Вода И её значение
Вода И её значение Алгоритм названия органического соединения
Алгоритм названия органического соединения Лекция 1 Основные понятия и законы химии
Лекция 1 Основные понятия и законы химии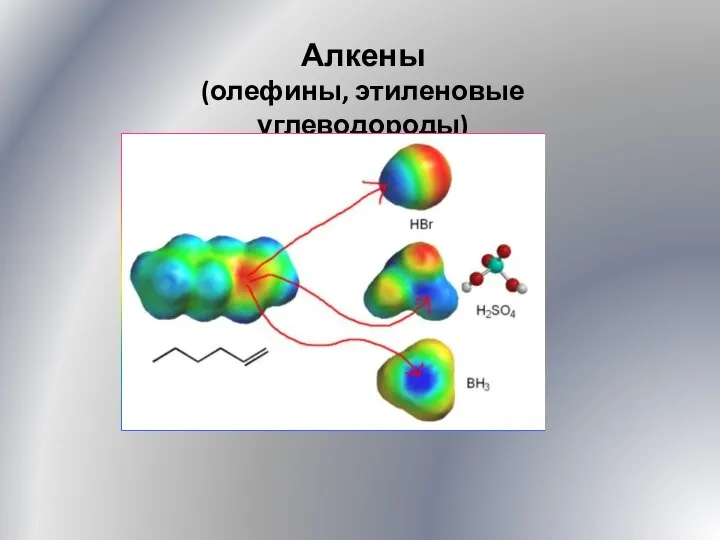 Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) DOC-20221011-WA0003
DOC-20221011-WA0003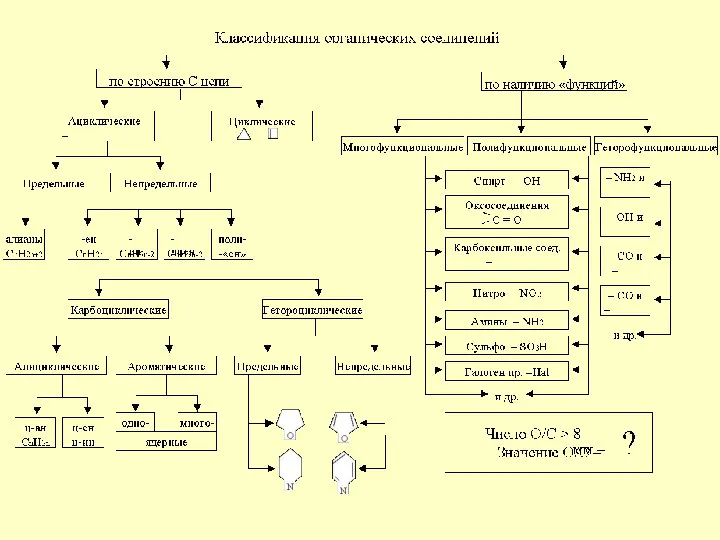 Классификация органических соединений
Классификация органических соединений Вода как хладагент (R718)
Вода как хладагент (R718)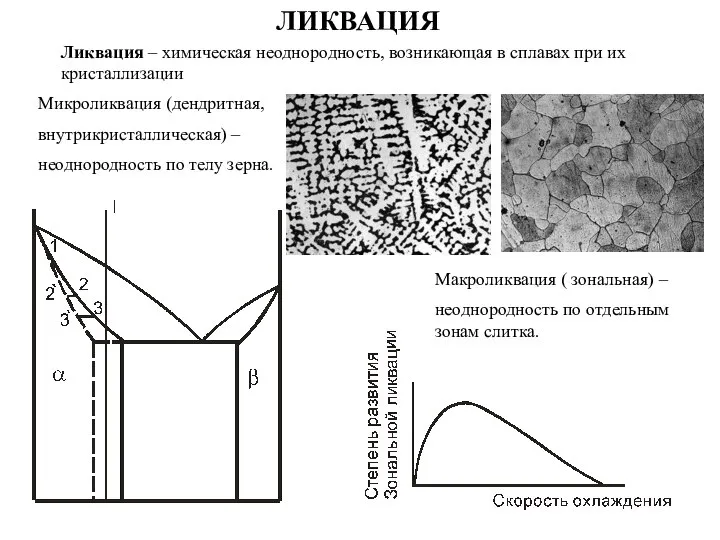 Ликвация. Микроликвация
Ликвация. Микроликвация Основные химические понятия и законы химии. (Часть 1)
Основные химические понятия и законы химии. (Часть 1) Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения
Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов
Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов მეტალები
მეტალები Альдегиды
Альдегиды Получение, свойства и применение алкенов
Получение, свойства и применение алкенов