Содержание
- 2. НЕМНОГО ИСТОРИИ Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного
- 3. 2 FeSO4 · 7Н2О + 4 КNO3 = Fe2О3 + 2 К2SO4 + 2НNO3 +13Н2О +2NO2
- 4. АЗОТНАЯ КИСЛОТА
- 6. HNO3 – азотная кислота Физические свойства 1. Молярная масса 63,016 г/моль 2. Бесцветная жидкость с резким
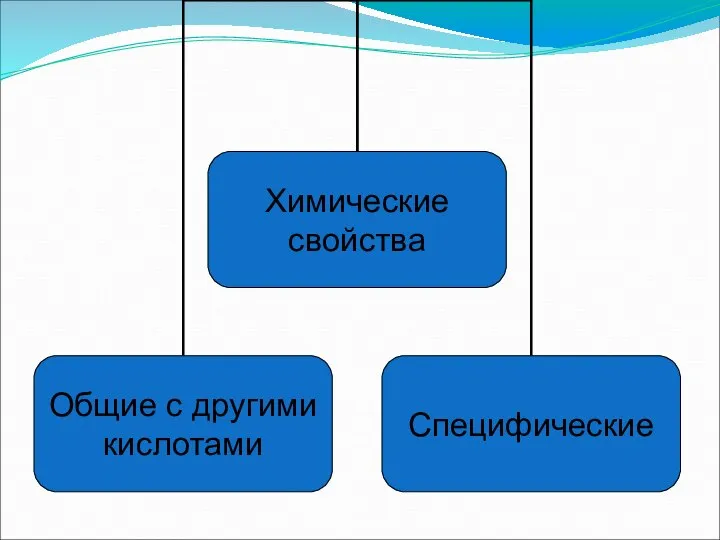
- 9. 1) Изменяет цвет индикаторов (диссоциация) HNO3 ⮀ 2) Взаимодействие с основными и амфотерными оксидами CuO+2HNO3⭢ 3)
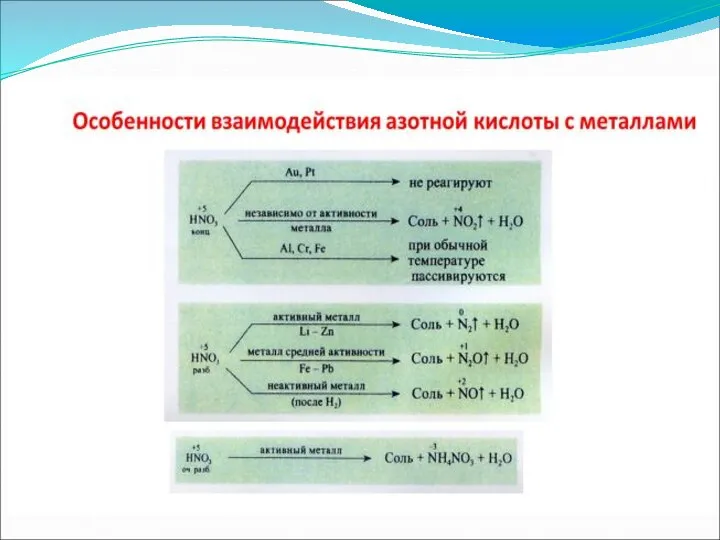
- 11. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 15. Разбавленная
- 16. Концентрированная
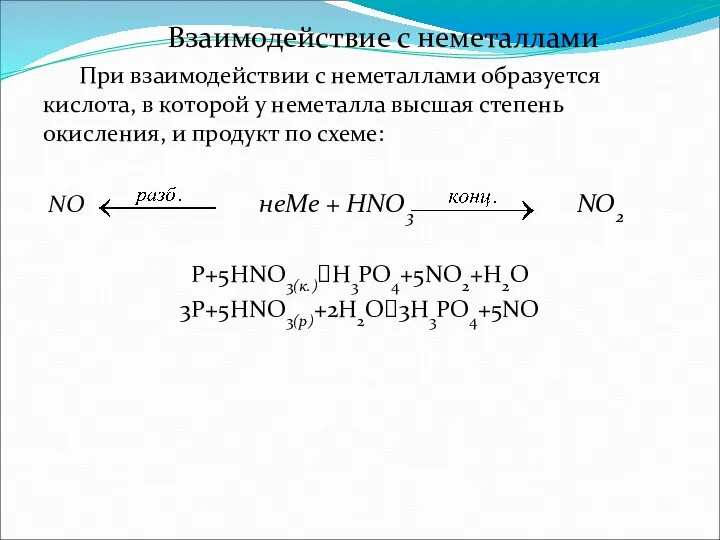
- 17. Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления,
- 18. Действие на органические вещества Белки при взаимодействии с конц.азотной кислотой разрушаются и приобретают жёлтую окраску .
- 19. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет
- 24. Найдите в учебнике информацию о порохе и напишите уравнение реакции, протекающую при горении пороха: ????
- 32. Скачать презентацию
























 Кислотно-основное равновесие
Кислотно-основное равновесие Строение атома
Строение атома Тема_6б_химическая_кинетика
Тема_6б_химическая_кинетика Соединения алюминия
Соединения алюминия Предмет химии. Вещества
Предмет химии. Вещества Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Применение алканов
Применение алканов Теория строения органических соединений
Теория строения органических соединений Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Курс химии для основных академических направлений подготовки специалистов НИЯУ МИФИ
Курс химии для основных академических направлений подготовки специалистов НИЯУ МИФИ Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Изомерия. Виды изомерии
Изомерия. Виды изомерии Добыча золота в России По теме «Внешние эффекты и права собственности»
Добыча золота в России По теме «Внешние эффекты и права собственности» Презентация на тему Изомерия
Презентация на тему Изомерия  Основные сведения о строении атома
Основные сведения о строении атома Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Пропи́н (метилацетилен, аллилен)
Пропи́н (метилацетилен, аллилен) Вазелин и вазелиновое масло
Вазелин и вазелиновое масло Строение атома
Строение атома Органическая химия
Органическая химия Амины (продолжение). 10 класс
Амины (продолжение). 10 класс Стирол - важнейшее производное бензола
Стирол - важнейшее производное бензола Презентация на тему Каучуки
Презентация на тему Каучуки  Cиликат кальция
Cиликат кальция Цветные опыты
Цветные опыты Полимеры и сополимеры акриловой и метакриловой кислот и их производных
Полимеры и сополимеры акриловой и метакриловой кислот и их производных