Слайд 2ПОНЯТИЕ ХИМИЧЕСКОЙ РЕАКЦИИ. ЯДЕРНЫЕ РЕАКЦИИ
Химические реакции, или химические явления, — это процессы,

в результате которых из одних веществ образуются другие, отличающиеся от исходных по составу или строению.
При протекании химических реакций не происходит изменения числа атомов того или иного элемента, взаимопревращения изотопов. С этой точки зрения особый тип процессов составляют ядерные реакции.
Слайд 3Типы ядерных реакций
Расщепление ядер. При бомбардировке элементарными частицами тяжелые ядра могут распадаться

на два ядра других элементов.
Термоядерный синтез. При высоких температурах ядра атомов могут соединяться в более тяжелые ядра.
Большинство ядерных реакций сопровождается выделением колоссального количества энергии, что и обусловливает их соответствующее применение.
Слайд 4Классификация реакций по числу и составу реагирующих веществ
Реакции соединения
Реакции разложения
Реакции

замещения
Реакции обмена.
Слайд 5Реакции соединения
Это такие реакции, при которых из двух или более исходных веществ

образуется один продукт взаимодействия. Исходные вещества могут быть как простыми, так и сложными.
4Р + 5О2 = 2Р2О5;
СО + С12 = СОС12;
4NO2 + О2 + 2Н2О = 4HNO3;
СаО + Н2О = Са(ОН)2.
Слайд 6Реакции разложения
Это такие реакции, при которых из одного исходного вещества образуются

два или более продукта.
Исходное вещество в реакциях такого типа должно быть сложное, а образующиеся вещества могут быть как простыми, так и сложными, например:
2НI = H2 + I2;
2КСlO3 = 2КС1 + 3О2;
(СuОН)2СО3 = 2СuО + Н2О + СО2.
Слайд 7Реакции замещения
Это реакции, в которых атомы простого вещества замещают в сложном

веществе атомы какого-нибудь элемента в сложном веществе.
Поскольку в реакциях замещения в качестве одного из реагентов обязательно участвует простое вещество, все превращения такого типа являются окислительно-восстановительными.
Zn + H2SO4 = H2↑ + ZnSO4;
2A1 +Fe2O3 = 2Fe + A12O3;
2CuO + С = 2Cu + CO2;
H2S + Br2 = 2HBr + S↓.
Слайд 8Реакции обмена
Реакции, при которых два сложных вещества обмениваются своими составными частями, называют

реакциями обмена.
Реакции обмена могут протекать непосредственно между двумя реагентами без участия растворителя:
SiO2 + 4HF = SiF4 + Н2О;
ZnO + 2KOH = K2ZnO2 + Н2O .
Реакции обмена, протекающие в растворах электролитов, принято называть реакциями ионного обмена. Такие реакции возможны лишь в том случае, если одно из образующихся веществ является слабым электролитом, выделяется из сферы реакции в виде газа или малорастворимого вещества (правило Бертолле):
NaNO2 + НС1 = NaCl + HNO2,
NO2- + Н+ = HNO2;
AgNO3 + NaCl = AgCl↓ + NaNO3,
Ag+ + Cl- = АgCl↓
Следует отметить, что предполагаемое образование в результате реакции ионного обмена малорастворимого соединения не является достаточным условием её протекания. Подобные реакции в большинстве случаев невозможны, если одно из исходных веществ также малорастворимо в воде:
Са3(РО4)2↓ + Na2CO3 → СаСО3 + Na3PO4.
Слайд 9Классификация реакций по изменению степеней окисления атомов химических элементов
К первой группе относят

реакции, протекающие без изменения степеней окисления атомов химических элементов. К ним относятся реакции ионного обмена, многие реакции разложения и соединения (в которых среди исходных веществ и продуктов реакции нет простых веществ):
2NaOH + H2SO4 = Na2SO4 + 2Н2О;
СаСО3 = СаО + СО2;
ВаО + Н2О = Ва(ОН)2.
Реакции, в ходе которых атомы химических элементов изменяют свои степени окисления, называют окислительно-восстановительными.
Слайд 10Процесс отдачи атомом электронов называют окислением, соответственно принятие электронов — это восстановление.
Исходное

вещество, содержащее окисляющийся атом, называется восстановителем. Окислителем называют вещество, в составе которого присутствует восстанавливающийся атом, т. е. тот, что отнимает электроны у другого атома. Сказанное выше справедливо для межмолекулярных окислительно-восстановительных реакций, в которых окислителем и восстановителем являются различные исходные вещества:
10ē
5Na2S+4O3 + 2KMn+7 O4 + 3H2SO4 = 5Na2S+6O4 + K2SO4 + 2Mn+2 SO4 + 3H2O.
В приведенной выше реакции в качестве восстановителя выступает сульфит натрия, окислителем является перманганат калия.
Бывает так, что и окисляющийся, и восстанавливающийся атомы входят в состав одного и того же вещества. Такие реакции называют внутримолекулярными. Примером может служить разложение дихромата аммония:
6ē
(N-3 H4)2Cr2+6 О7 N20 + Cr2+3O3 + 4Н2О.
Слайд 11Встречаются реакции, в ходе которых изменяются степени окисления атомов одного и того

же элемента. Если при этом часть атомов понижает, а часть — повышает степени окисления, реакцию называют диспропорционированием. Например, взаимодействие хлора с горячим раствором гидроксида калия — реакция диспропорционирования, поскольку один из атомов хлора повышает свою степень окисления от 0 до +5, восстанавливая тем самым пять других атомов хлора от степени окисления 0 до -1:
ЗС120 + 6КОН 5KC1-1 + КСl+5O3 + ЗН2О.
Если степени окисления атомов одного и того же элемента в результате реакции сближаются, т. е. из различных превращаются в одинаковую, — эта реакция контрдиспропорционирования. Подобным образом оксид серы (IV) окисляет сероводород:
4ē
S+4O2 + 2H2S-2 = 3S0 + 2H2O
Слайд 12Классификация реакции по тепловому эффекту
Протекание химических реакций в большинстве случаев сопровождается выделением

или поглощением энергии. С практической точки зрения наибольший интерес представляет выделение или поглощение в ходе реакции тепловой энергии, называемое ее тепловым эффектом.
Реакции, протекающие с выделением тепловой энергии, называют экзотермическими, с поглощением теплоты — эндотермическими. Уравнение реакции, в котором указан ее тепловой эффект, называют термохимическим.
Поскольку переход вещества из одного агрегатного состояния в другое также сопровождается затратой или выделением теплоты, в термохимическом уравнении часто указывают агрегатное состояние всех участников реакции:
H2(г) + Cl2(г) = 2HCl(г) + 184,8 кДж
N2(г) + О2(г) = 2NO – 180,6 кДж
Значение теплового эффекта реакции удобно приводить в расчете на
1 моль одного из участников реакции, поэтому в термохимических уравнениях часто можно встретить дробные коэффициенты:
l/2N2(r) + 3/2Н2(Г) = NH3(r) + 46,2 кДж/моль.
Слайд 13Классификация реакций по фазовому составу веществ
Фазой называют однородную по составу и свойствам

часть системы, которая отделена от других фаз поверхностью (границей) раздела. Например, воздух, как и любая другая смесь газов, представляет собой однофазную систему. Карбонат кальция в воде — двухфазная система, твердые частицы карбоната кальция отделены от жидкой фазы — насыщенного раствора этой соли — поверхностью кристаллов. Если через данную суспензию пропускать углекислый газ, система становится трехфазной, и в ней начинает протекать реакция образования гидрокарбоната кальция:
СаСО3 + Н2О + СО2 = Са(НСО3)2.
С точки зрения числа фаз в реагирующей системе все химические реакции подразделяют на гомогенные и гетерогенные.
В гомогенных (однофазных) реакциях исходные вещества и продукты реакции находятся в одной фазе. Это все реакции между газообразными веществами с образованием газов, многие реакции, протекающие в растворах:
2СО(г) + О2(г) = 2СО2(г);
NaOH(p-p) + НС1(р-р) = NaCl(p-p) + Н2О(ж);
Если хотя бы один из участников реакции (включая катализатор) находится в иной фазе по сравнению со всеми остальными, реакцию называют гетерогенной (многофазной).
Любая реакция с участием твердого вещества является гетерогенной. Если упомянутую выше смесь оксидов кальция и кремния нагреть, пойдет гетерогенная твердофазная реакция: СаО + SiO2 = CaSiO3.
Реакции в гетерогенных системах протекают на границе раздела фаз, поэтому на их скорость очень существенное влияние оказывает степень измельчения твердых веществ, а также интенсивность перемешивания (при наличии жидкой фазы).
Слайд 14Классификация реакции по участию катализатора
Реакции, для протекания которых требуется присутствие катализатора, называют

каталитическими.
Каталитические реакции используют в важнейших многотоннажных химических производствах: получении серной и азотной кислот, в производстве аммиака, в нефтепереработке, в синтезе стереорегулярных полимеров и др.
Все биохимические процессы, протекающие в клетках живых организмов, идут с участием биологических катализаторов — ферментов, такие реакции называют ферментативными. Современная биотехнология использует ферментативные процессы в промышленном масштабе для получения продуктов питания (сыры, дрожжи, пиво), лекарственных препаратов (пенициллин), химических веществ (молочная кислота, акриламид) трансгенных форм растений и животных.
Без участия катализаторов идут реакции, которые принято называть некаталитическими.
Слайд 15Классификация реакций по направлению протекания
К необратимым относят те химические реакции, продукты которых

не могут взаимодействовать с образованием исходных веществ. Иными словами, реакция в данных условиях может протекать только в одном направлении.
Необратимых реакций не очень много. К ним можно отнести, например, реакцию получения ацетилена из карбида кальция:
СаС2 + 2Н2О = НС≡СН↑ + Са(ОН)2.
Обратимые реакции протекают в данных условиях в двух взаимно противоположных направлениях.
Стрелки обратимости в уравнениях таких реакций как раз и указывают на возможность протекания взаимодействия в прямом и обратном направлениях:
кат.,t, p
ЗН2 + N2 2NH3;
кат.,t, p
2SO2 + О 2 2SO3;
СН3ОН + НС1 ⇄ СН3С1 + Н2О.
Обратимость химических реакций создает много проблем в химической технологии. При прохождении через колонну синтеза, смесь азота и водорода лишь на 15—17% превращается в аммиак. Затем продукт реакции приходится отделять от непрореагировавших газов и вновь возвращать их в реактор.
С другой стороны, обратимость реакций, протекающих в живых организмах, — это основа важнейшего природного процесса обмена веществ.
Слайд 18ХИМИЧЕСКИЕ ВЕЩЕСТВА И СМЕСИ
Химической системой называют вещество или совокупность веществ, ограниченных от

окружающей среды реальными или воображаемыми границами и являющиеся предметом рассмотрения с точки зрения их химического состава и свойств.
Слайд 19Классификация химических систем
Химические системы
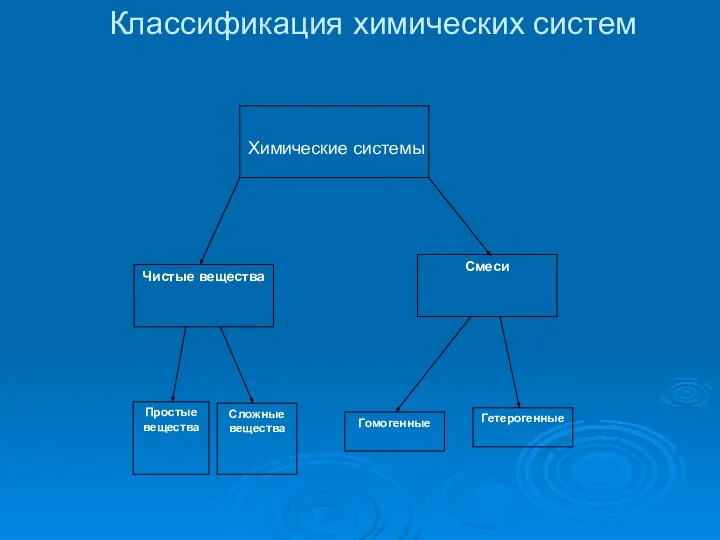
Слайд 20Если смесь веществ однородна, то есть между различными её компонентами нет границы

(поверхности) раздела, её называют гомогенной.
Смеси могут состоять из веществ, которые практически не растворимы или ограниченно растворимы друг в друге. В этом случае их называют гетерогенными.
Слайд 21РАСТВОРЫ
Раствор представляет собой гомогенную систему, состоящую из растворителя, частиц растворённого вещества (одного

или нескольких) и продуктов их взаимодействия.
Образование раствора — это физико-химический процесс, т. е. помимо распределения частиц одного вещества среди частиц другого могут происходить химические явления: диссоциация электролита, образование сольватов (в водных растворах — гидратов).
Понятия растворитель и растворенное вещество достаточно условны. Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью, твердого вещества с твердым веществом, растворителем считают тот компонент, которого в растворе больше. Если одним из компонентов раствора является вода, ее чаще всего и считают растворителем.
Слайд 22Растворы всегда однородны и по агрегатному состоянию могут представлять собой газ, жидкость

или твердое вещество. Любые газы смешиваются друг с другом в любых соотношениях, такие растворы чаще называют газовыми смесями. В жидкостях могут растворяться газы, другие жидкости и твердые вещества (агрегатное состояние такого раствора — жидкое), аналогично существуют растворы газов, жидкостей и твердых веществ в твердых веществах.
Слайд 23В зависимости от состояния растворенного вещества растворы подразделяют на следующие виды:
молекулярные (растворы

неэлектролитов) — раствор глюкозы, сахара или формальдегида в воде, йода в спирте или в бензоле, белого фосфора в сероуглероде;
молекулярно-ионные (растворы слабых электролитов) — водный раствор азотистой кислоты, раствор уксусной кислоты в этаноле;
ионные (растворы сильных электролитов) — водные растворы нитрата калия, гидроксида натрия, хлороводорода.
Слайд 24ПОНЯТИЕ О ДИСПЕРСНЫХ СИСТЕМАХ
И ИХ КЛАССИФИКАЦИЯ
Дисперсными называют гетерогенные системы, в которых

одно вещество в виде очень мелких частиц равномерно распределено в объёме другого.
То вещество, которое распределено в объёме другого, называют дисперсной фазой. Второе вещество носит название дисперсионной среды.
В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды различают восемь типов дисперсных систем.
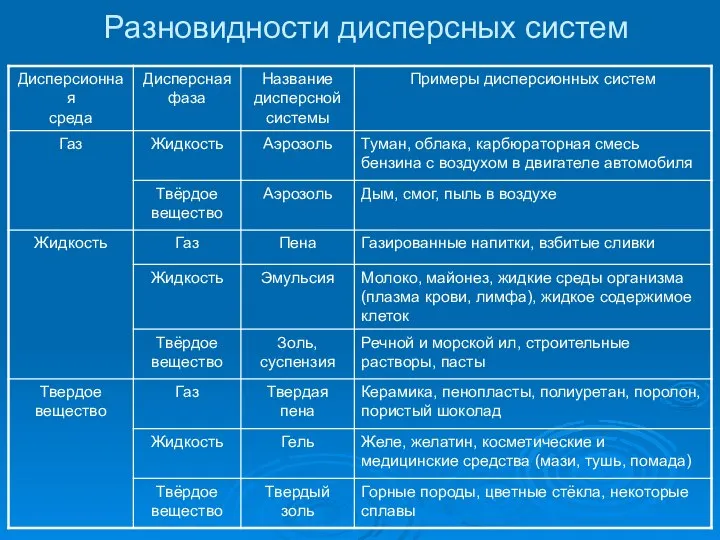
Слайд 26Грубодисперсные системы с твёрдой дисперсной фазой и жидкой дисперсионной средой называют суспензиями.
Суспензии,

в которых седиментация идёт очень медленно из-за малой разности в плотностях дисперсионной среды и дисперсной фазы, называют взвесями.
Грубодисперсную систему можно получить из двух несмешивающихся друг с другом жидкостей – такие системы называются эмульсиями.
Коллоидные системы. Коллоиды занимают промежуточное положение между грубодисперсными системами и истинными растворами.
Если частицы дисперсной фазы достаточно малы, коллоидная система напоминает истинный раствор, отсюда и происходит название – коллоидный раствор.
























 Алкены. Строение
Алкены. Строение Строение атома
Строение атома Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия
Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии
Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии Применение алкенов
Применение алкенов Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам Химическая технология. Структура ВКР
Химическая технология. Структура ВКР ТБ_1 (1)
ТБ_1 (1) Алканы. Этан
Алканы. Этан Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс Селективность (реакторы)
Селективность (реакторы) Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Массовые доли веществ задачи
Массовые доли веществ задачи Агрегатные состояния вещества
Агрегатные состояния вещества Основания. Равновесия в растворах
Основания. Равновесия в растворах Химические свойства основных оксидов. 9 класс
Химические свойства основных оксидов. 9 класс Спирты. Классификация
Спирты. Классификация Микроструктура железоуглеродистых сплавов в равновесном состоянии
Микроструктура железоуглеродистых сплавов в равновесном состоянии Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Производство метанола
Производство метанола Презентация на тему Серная кислота
Презентация на тему Серная кислота  Вирощування кристалів солей
Вирощування кристалів солей Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону
Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону Металлы. Группы металлов
Металлы. Группы металлов Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия