Слайд 2«Vita brevis,
ars longa»
Жизнь коротка,
наука обширна.

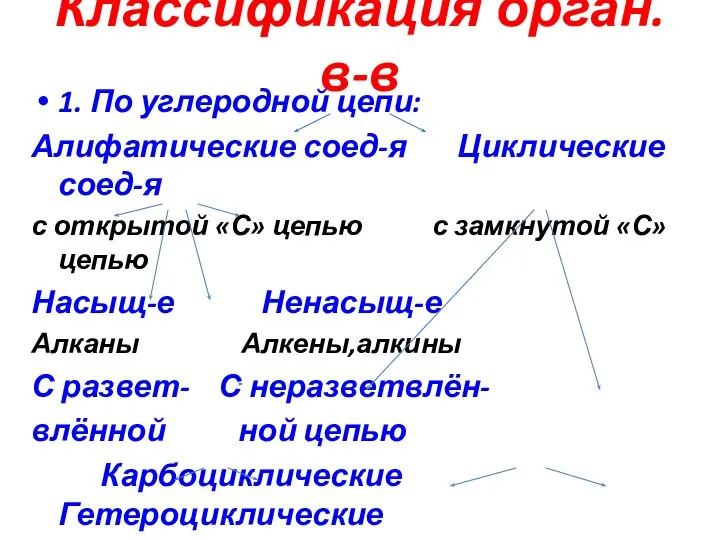
Слайд 3Классификация орган. в-в
1. По углеродной цепи:
Алифатические соед-я Циклические соед-я
с открытой «С» цепью
с замкнутой «С»цепью
Насыщ-е Ненасыщ-е
Алканы Алкены,алкины
С развет- С неразветвлён-
влённой ной цепью
Карбоциклические Гетероциклические
в цикл входит т. «С» в цикл входят «С,N,O,S»
ЦАlk Ar насыщен-е ненасыщен-е
Слайд 4Классификация орган. в-в
2. По функциональным группам (ФГ)
ФГ- это заместители неуглеводородного характера,

определяющие принадлежность в-ва к определённому классу и его химические свойства.
Класс соединений ФГ Класс соединений ФГ
1.Галогенопроиз-е–I,-Сl,-Br 5.Нитропроизвод-е –NO2
2.Гидроксипроизв-е -ОН 6.Нитрилы -СΞN
(спирты,фенолы) 7.Оксопроизводные
3.Алкоксипроизв-е -О- (альдегиды-CHO кетоны>C=O
(простые эфиры) карбоновые к-ты –СООН)
4.Аминопроизв-е 8.Тиолы (тиоспирты)-SH
первич-е-NH2,втор.-NH-,третичн.амины-N<
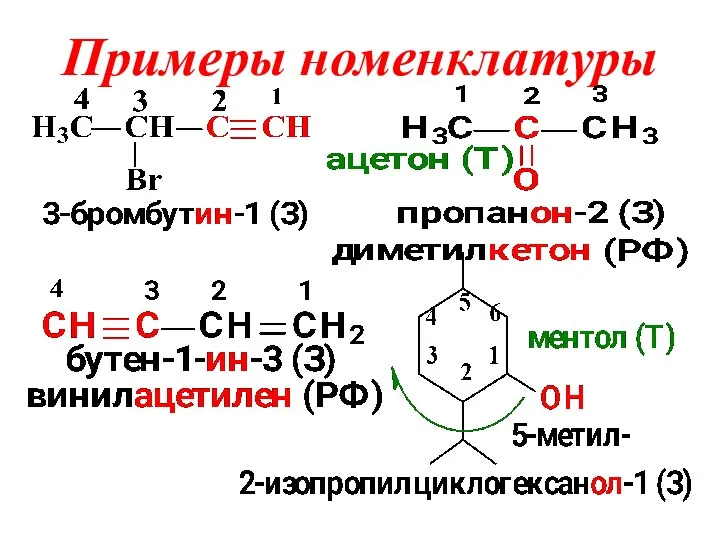
Слайд 5Номенклатура ИЮПАК
1. Тривиальное (историческое) название
2. Заместительная номенклатура:
Выбирается самая длинная углеводородная цепь и
нумеруется

с того конца где:
а)больше разветвлений (алканы);
б) ближе кратные связи (алкены,алкадиены, алкины);
в)наличие старшей функциональной группы (ФГ)
(спирты, амины, кетоны и т.д.).
Далее перечисляются заместители в алфавитном
порядке с указанием порядкового номера, а в конце
указывается наименование углеводородной цепи .
Слайд 6Названия в ненасыщенных соединениях строятся путем замены суффикса – ан в соответствующем

алкане на -ен (алкены), Ξ –ин (алкины). При наличии двух и более двойных связей применяются суффиксы –адиен, -атриен и т.д.
3. Радикально-функциональная номен-ра:
Корень названия - старшая ФГ, остальные радикалы перечисляют в приставке по старшинству
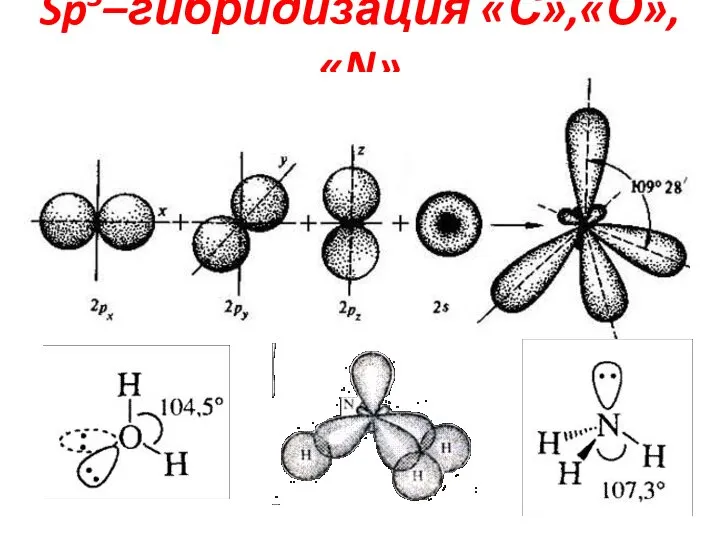
Слайд 9Гибридизация атома «С»
Атом «С» в органич-х соед-ях 4-х валентен
ℓ⁻распологаются на S-АО и

p-АО
При перекрывании АО образуются гибридные АО, обеспечивающие более прочные связи
В зависимости от числа всупивших в гибридизацию АО атом «С» может находиться в виде Sp3,Sp2,Sp - гибридизации
Слайд 10Sp3–гибридизация «С»
4-е Гибридные АО расположены в виде
тетраэдра с углом 109,50.
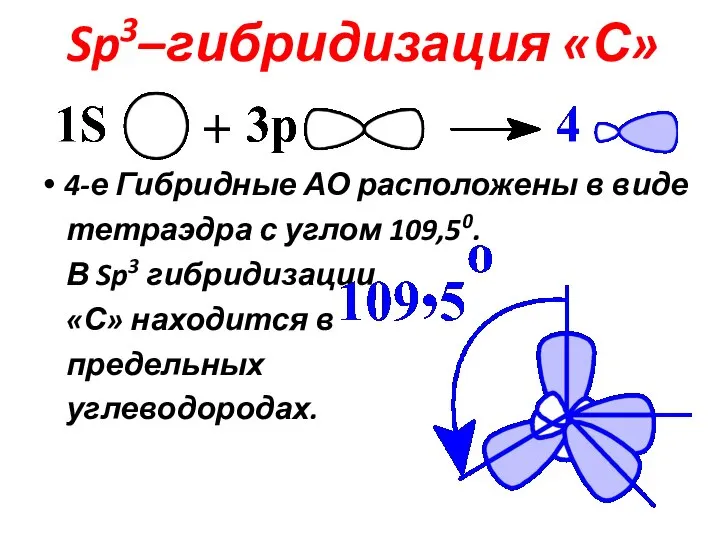
В Sp3 гибридизации
«С» находится в
предельных
углеводородах.
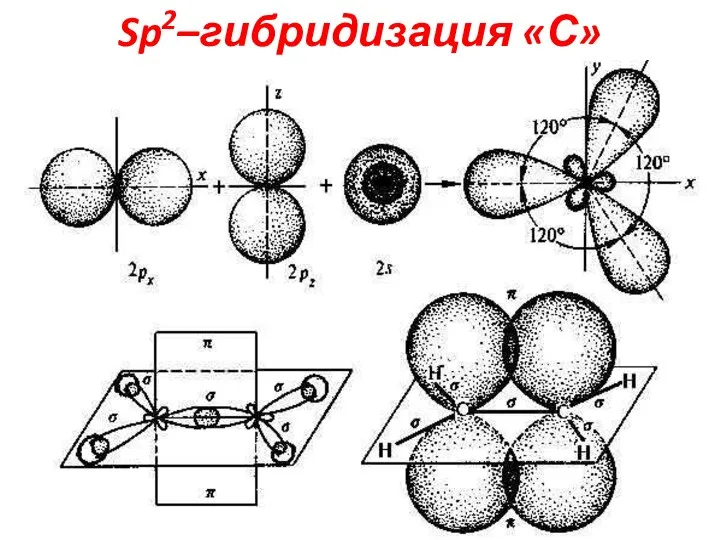
Слайд 12Sp2–гибридизация «С»
3-и Гибридные АО располагаются в одной плоскости под углом 1200, а
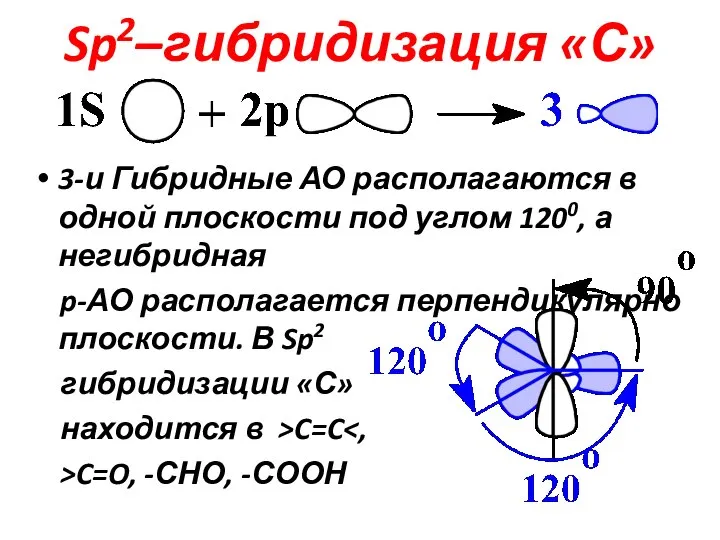
негибридная
p-АО располагается перпендикулярно плоскости. В Sp2
гибридизации «С»
находится в >C=C<,
>C=O, -СНО, -СООН
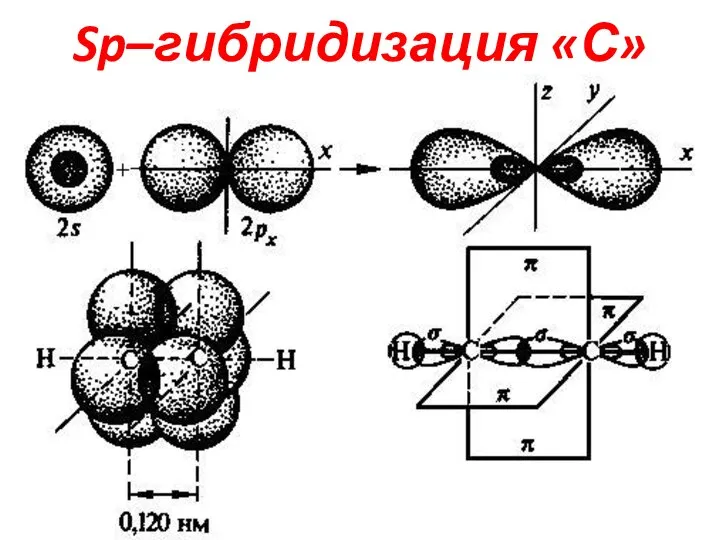
Слайд 14Sp–гибридизация «С»
2-е Гибридные АО расположены линейно в одной плоскости под углом 1800,
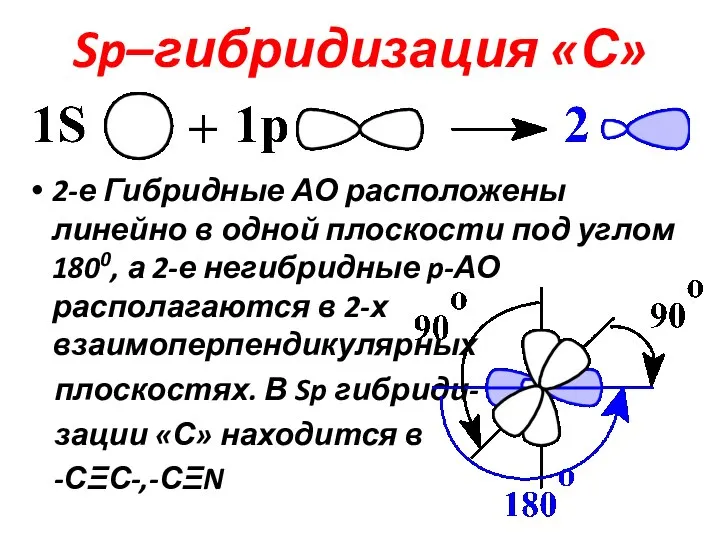
а 2-е негибридные p-АО располагаются в 2-х взаимоперпендикулярных
плоскостях. В Sp гибриди-
зации «С» находится в
-СΞС-,-СΞN
Слайд 16Химические связи:
1. Локализованная химическая связь:
1.1. Ковалентная σ- и π-связь-образована за счёт двух

ℓ⁻ от каждого атома
1.2. Донорно-акцепторная (координацион-я) связь - образована за счёт пары ℓ⁻одного атома и вакантной орбитали другого атома
триметиламмоний
йодид
1.3. Семиполярная
1.4. Водородная
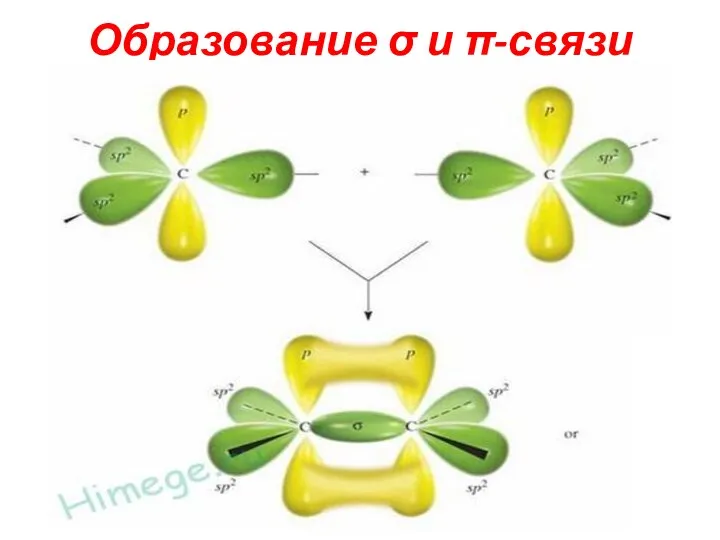
Слайд 17Ковалентная σ и π-связи
1. Осевое перекрывание гибридных и негибридных АО приводит к
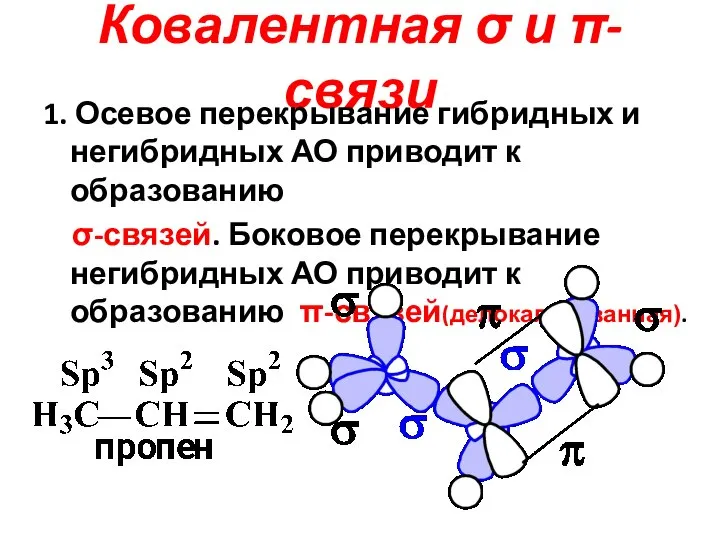
образованию
σ-связей. Боковое перекрывание негибридных АО приводит к образованию π-связей(делокализованная).
Слайд 19Характеристики ковалентной связи:
1. Энергия связи (Е) - мера прочности связи, чем↑Е, тем

прочнее связь
2. Длина связи - чем короче связь,тем ↑Е связи
Связь укорачивается из-за перекрывания pАО, чем короче связь, тем ↑Е связи, тем прочнее связь
Слайд 20Характеристики ковалентной связи:
3. Полярность связи обусловлена электроотрицательностью атомов (ЭО)
ЭО - это способность

атома притягивать ℓ⁻
Чем ↑разность ЭО, тем ↑полярность связи
4. Поляризуемость - мера смещения ℓ⁻связи
под действием внешнего электромагнитного
поля. Поляризуемость π-связи > σ-связи.
Слайд 21Электронные эффекты
Смещение ℓ⁻плотности по σ-связи в сторону более ЭО атома называется индуктивным
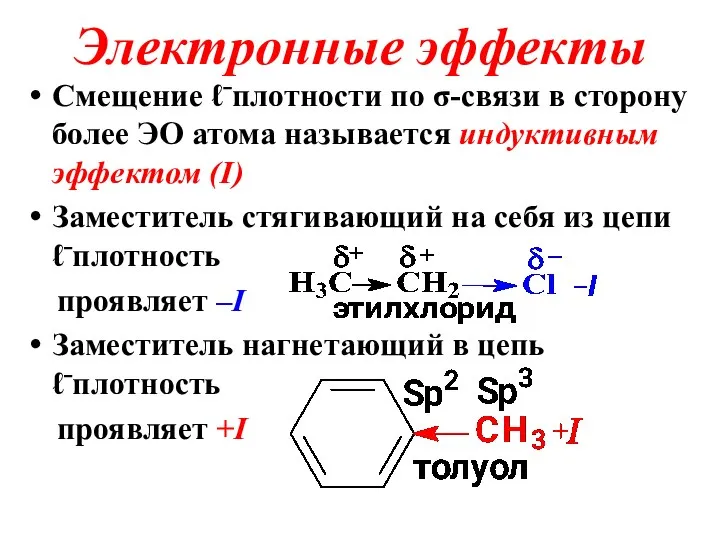
эффектом (I)
Заместитель стягивающий на себя из цепи ℓ⁻плотность
проявляет –I
Заместитель нагнетающий в цепь ℓ⁻плотность
проявляет +I
Слайд 22Типы сопряжения:
Сопряжение - это образование в молекуле
единого делокализованного ℓ⁻облака в
результате перекрывания негибридных
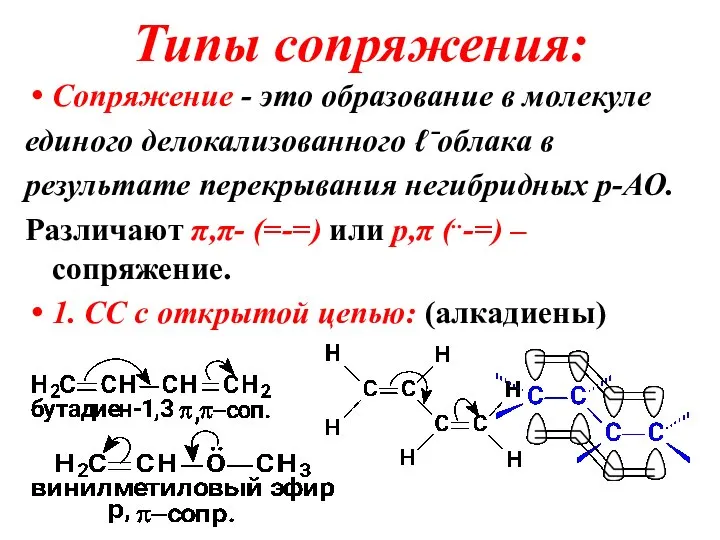
p-АО.
Различают π,π- (=-=) или p,π (..-=) – сопряжение.
1. СС с открытой цепью: (алкадиены)
Слайд 23Типы сопряжения
2. СС с замкнутой цепью: (арены,гетероциклы)
π,π-Сопряжение-перекрываются негибридные p-АО
π-связей
p,π-Сопряжение – перекрываются
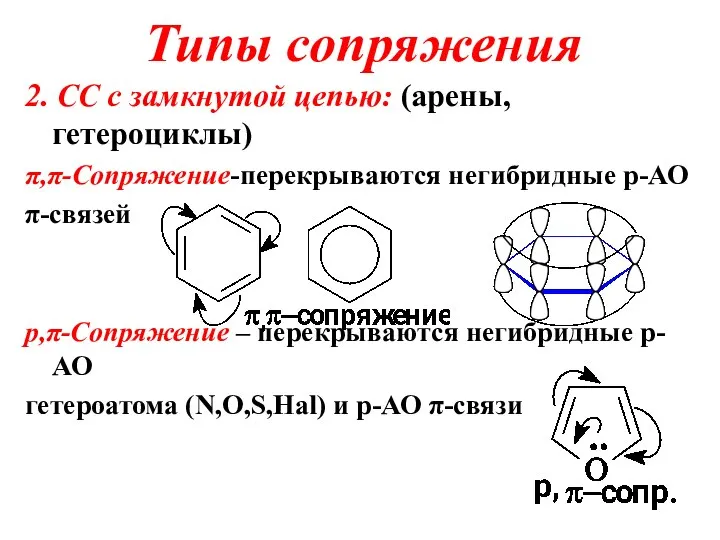
негибридные p-АО
гетероатома (N,O,S,Hal) и p-АО π-связи
Слайд 24Электронные эффекты
Мезомерный эффект (М) - смещение ℓ⁻плотности по сопряжённой системе (СС): π,π-
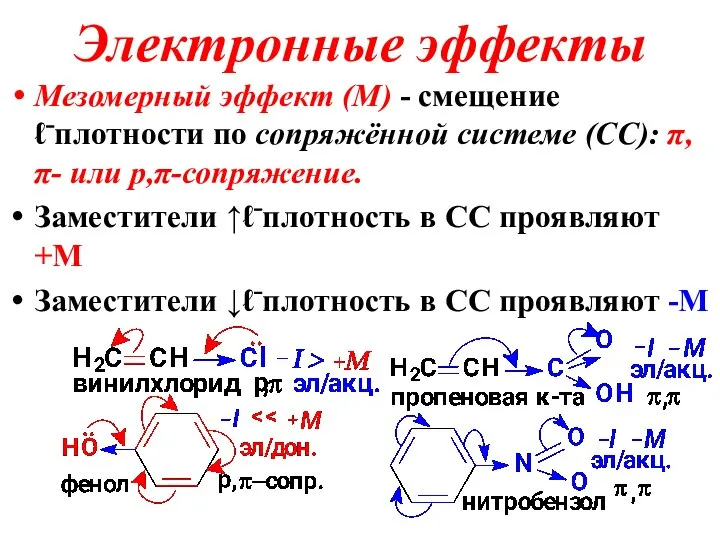
или p,π-сопряжение.
Заместители ↑ℓ⁻плотность в СС проявляют +М
Заместители ↓ℓ⁻плотность в СС проявляют -М
Слайд 25Заместители
Заместители вытягивающие ℓ⁻плотность из цепи - электроно-акцепторные замест-ли
Заместители нагнетающие ℓ⁻плотность в цепь

- электроно-донорные заместители
Слайд 26Теория резонанса
Резонансные структуры - это предельные структуры, вызванные смещением ℓ⁻плотности по
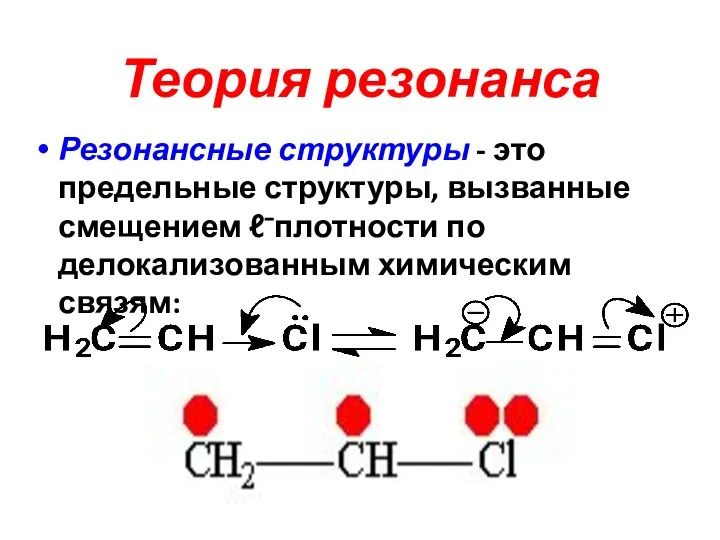
делокализованным химическим связям:




















 Применение алкенов
Применение алкенов Строение электронных оболочек атомов элементов малых периодов
Строение электронных оболочек атомов элементов малых периодов Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Углеводы
Углеводы Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Азот
Азот Презентация на тему Молярный объем
Презентация на тему Молярный объем  Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс Пропиновые кислоты
Пропиновые кислоты ОВР химияПрезентация
ОВР химияПрезентация Ионная связь. Вещества ионного ( немолекулярного) строения
Ионная связь. Вещества ионного ( немолекулярного) строения Презентация на тему Витамин C
Презентация на тему Витамин C  Железо и его соединения
Железо и его соединения Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения Подготовка к экзамену. Органическая химия
Подготовка к экзамену. Органическая химия Структура периодической таблицы элементов
Структура периодической таблицы элементов Азот. Нахождение в природе
Азот. Нахождение в природе Rozcieńczanie i zatężanie roztworów
Rozcieńczanie i zatężanie roztworów Арены. Бензол
Арены. Бензол Тяжелая вода
Тяжелая вода Генетические ряды неорганических соединений
Генетические ряды неорганических соединений Метаболизм азота
Метаболизм азота История создания периодической таблицы
История создания периодической таблицы Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена
Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена