Содержание
- 2. 1. Основные понятия ОВР 2 Окислительно-восстановительные реакции (ОВР) – это реакции, сопровождающиеся изменением степени окисления атомов
- 3. 1. Основные понятия ОВР 3 Рассмотрим на примере следующей реакции: Zn0 + Cu+2SO4 = Zn+2SO4 +
- 4. 1. Основные понятия ОВР 4 Cu+2 + 2e = Cu0 - восстановление - окислитель Восстановление –
- 5. 1. Основные понятия ОВР 5 Вещество, содержащее атомы элементов в более низкой с.о., называется восстановленной формой
- 6. 1. Основные понятия ОВР 6 В ОВР участвуют две ОВ - пары: ВФ одной пары отдает
- 7. 2. Окислители и восстановители 7 Окислители и восстановители Важнейшими окислителями являются: неметаллы – O2, O3, Cl2,
- 8. 2. Окислители и восстановители 8 Важнейшими восстановителями являются: нейтральные атомы металлов – K, Ca, Ba, Zn,
- 9. 2. Окислители и восстановители 9 Таким образом, элемент в высшей с.о. проявляет только окислительные свойства, элемент
- 10. 3. Составление уравнений ОВР 10 Составление уравнений ОВР 1. Определить элементы, которые способны изменять свою с.о.
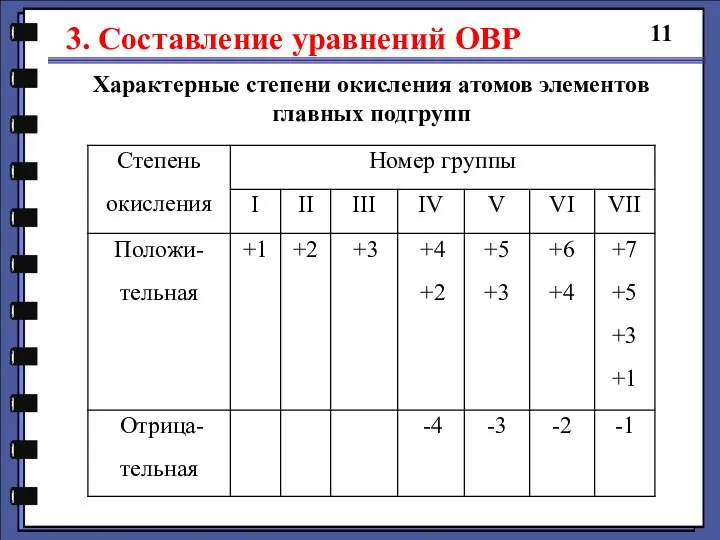
- 11. 3. Составление уравнений ОВР 11 Характерные степени окисления атомов элементов главных подгрупп
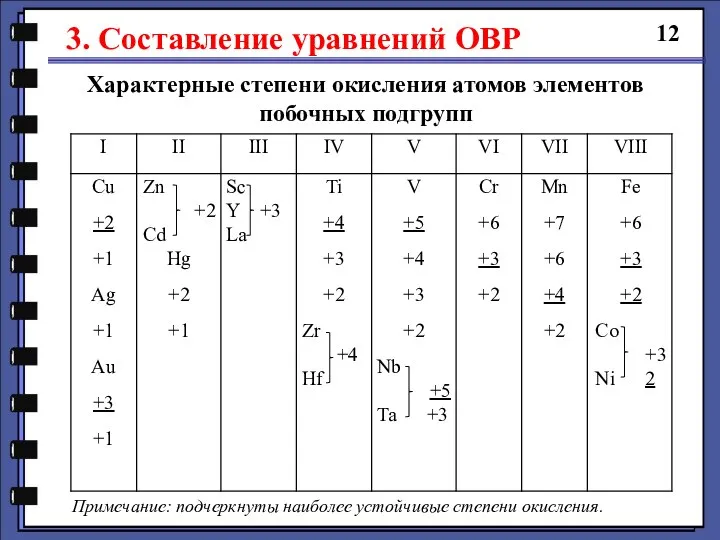
- 12. 3. Составление уравнений ОВР 12 Характерные степени окисления атомов элементов побочных подгрупп Примечание: подчеркнуты наиболее устойчивые
- 13. 3. Составление уравнений ОВР 13 а) с.о. водорода в соединениях обычно равна +1 (H2+1O-2), кроме соединений
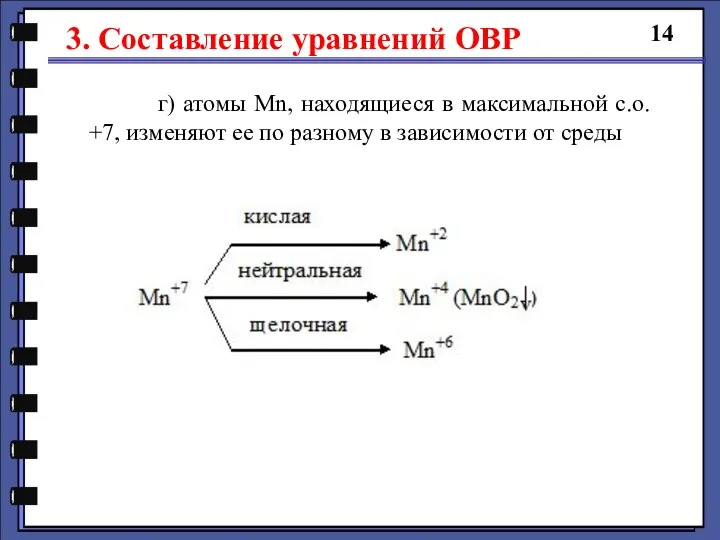
- 14. 3. Составление уравнений ОВР 14 г) атомы Mn, находящиеся в максимальной с.о. +7, изменяют ее по
- 15. 3. Составление уравнений ОВР 15 д) если в реакции изменяют с.о. атомы одного и того же
- 16. 3. Составление уравнений ОВР 16 е) при выводе продуктов соединений хрома следует помнить, что в щелочной
- 17. 3. Составление уравнений ОВР 17 4. Составить электронные уравнения с учетом внутримолекулярных индексов а) атомы хрома
- 18. 3. Составление уравнений ОВР 18 5. Справа от электронных уравнений проводим вертикальную черту и цифры, стоящие
- 19. 3. Составление уравнений ОВР 19
- 20. 3. Составление уравнений ОВР 20 Если выведенная формула продукта совпадает со средой, то при наличии в
- 21. 3. Составление уравнений ОВР 21 Если новая с.о. элемента отрицательная, то для вывода формулы продукта реакции
- 22. 3. Составление уравнений ОВР 22 7. Поставить основные коэффициенты в уравнении перед окислителем и восстановителем и
- 23. 3. Составление уравнений ОВР 23 Пример. Составьте уравнение ОВР. 2 Cr+3Cl3 + 3 Br20 + 16
- 24. 3. Составление уравнений ОВР 24 Кислотного остатка Cl- нет в правой части уравнения, поэтому объединяем его
- 25. 4. Типы ОВР 24 Типы ОВР Межмолекулярные реакции К ним относятся реакции, в которых окислитель и
- 26. 24 2. Внутримолекулярные реакции К ним относятся реакции, когда окислитель и восстановитель находятся в одном и
- 27. 24 3. Реакции диспропорционирования В этих реакциях вещество, содержащее элемент в промежуточной с.о., образует соединения с
- 28. 4. Окислительно-восстановительный потенциал 24 Окислительно-восстановительный потенциал (ОВ-потенциал) Количественной характеристикой окислительно-восстановительной способности веществ, т.е. способности отдавать и
- 29. 24 Значение ОВ – потенциала зависит от природы окислителя и восстановителя, их концентрации и температуры. Эта
- 30. 24 Из двух ОВ – пар более сильными окислительными свойствами обладает окислитель пары с более высоким
- 31. 24 Для самопроизвольно протекающей ОВР электродвижущая сила (Е), равная разности потенциалов о-ля и в-ля, должна быть
- 32. 24 4. Окислительно-восстановительный потенциал Пример. Даны вещества: K2Cr2O7, Na2SO4, Na2SO3, Cr2(SO4)3, H2SO4. Составить уравнение возможной ОВР
- 33. 24 4. Окислительно-восстановительный потенциал φ0II > φ0I, следовательно, более сильным окислителем является K2Cr2O7, а более сильным
- 35. Скачать презентацию





























 Аминокислоты. Пептиды
Аминокислоты. Пептиды Электролитическая диссоциация
Электролитическая диссоциация Периодический закон и строение атома
Периодический закон и строение атома Серная кислота и для чего используется
Серная кислота и для чего используется Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы Оксиды
Оксиды Химико-металлургические методы
Химико-металлургические методы Презентация на тему Каучук
Презентация на тему Каучук  Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Строение вещества
Строение вещества Поликонденсация. Особенности процесса
Поликонденсация. Особенности процесса Синтетические душистые вещества
Синтетические душистые вещества Свойства Н2
Свойства Н2 Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Классификация химических реакций
Классификация химических реакций Презентация на тему Решение задач на смеси, сплавы, растворы
Презентация на тему Решение задач на смеси, сплавы, растворы  Реакция нейтрализации
Реакция нейтрализации Нефть и газ
Нефть и газ Мышьяк (As)
Мышьяк (As) Газообразное состояние вещества
Газообразное состояние вещества Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей
Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей Теория электролитической диссоциации
Теория электролитической диссоциации Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи