Содержание
- 2. Цели: Изучить новый класс органических соединений – алкины, рассмотреть физические и химические свойства, способы получения ацетилена
- 3. Химическая разминка Что такое углеводороды? Какие углеводороды относятся к непредельным? Что такое алкины? Что такое гибридизация?
- 4. Назовите вещество CH₃ CH₃ І І CH ≡ C — C — C H ₂ —
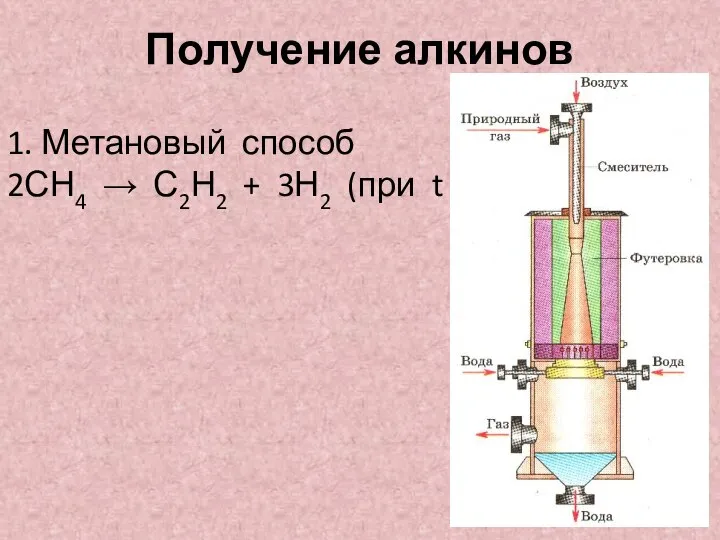
- 5. Получение алкинов 1. Метановый способ 2СН4 → С2Н2 + 3Н2 (при t =15000С)
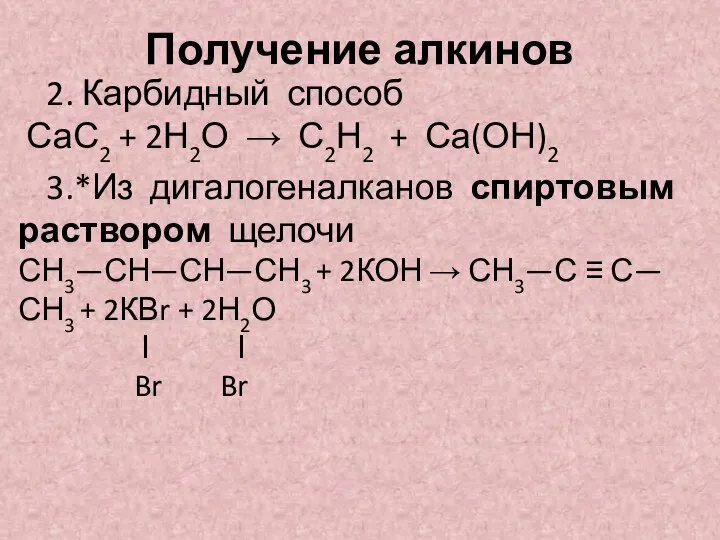
- 6. Получение алкинов 2. Карбидный способ СаС2 + 2Н2О → С2Н2 + Са(ОН)2 3.*Из дигалогеналканов спиртовым раствором
- 7. Физические свойства Ацетилен – газ легче воздуха, мало растворим в воде, в чистом виде почти без
- 8. Электрофильное присоединение Происходит в две стадии по месту расположения пи- связи (сначала разрушается одна пи-связь, образуется
- 9. Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂ Качественная реакция на пи-связь обесцвечивание бромной воды.
- 10. Гидрирование Закончить уравнения реакций. 2. Присоединение водорода: СН ≡ СН + Н2 → Y 1 стадия:
- 11. Ответ для реакции гидрирования Присоединение водорода: СН ≡ СН + 2Н2 → CH₃—CH₃ 1 стадия: СН
- 12. Гидрогалогенирование Составить уравнение реакции 1 стадии присоединения хлороводорода. 3.присоединение галогеноводорода СН ≡ СН + НСl →
- 13. Ответ для реакции гидрогалогенирования СН ≡ СН + НСl → СН2= СНСl – винилхлорид Продукт первой
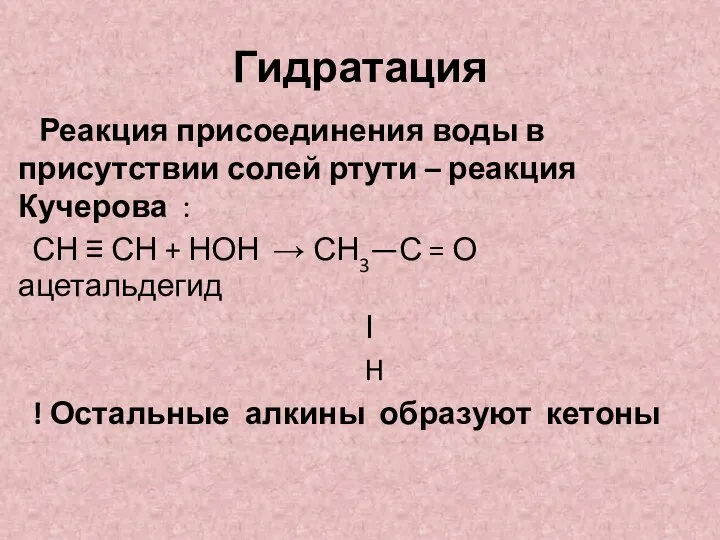
- 14. Гидратация Реакция присоединения воды в присутствии солей ртути – реакция Кучерова : СН ≡ СН +
- 15. Окисление 1. Горение(закончить уравнение реакции): С2Н2 + О2 → ? Ацетилен горит коптящим пламенем, т.к. соотношение
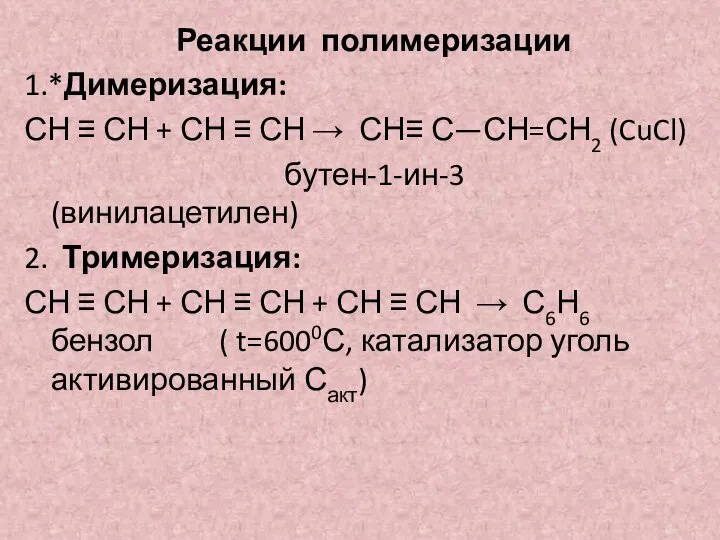
- 16. Реакции полимеризации 1.*Димеризация: СН ≡ СН + СН ≡ СН → СН≡ С—СН=СН2 (CuCl) бутен-1-ин-3 (винилацетилен)
- 17. Неоконченный текст Вещество с формулой C₂H₂ называется ¹ _ _ _ _ . Он является первым
- 18. Выполните задание 1 уровень Закончить уравнения реакций: 1. C₂H₂+Cl₂→ 2. C₃H₄+O₂→ 3. CH ≡ CH—CH₃+HBr→ 4.
- 20. Скачать презентацию













 Кислород
Кислород Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Деформация полимеров
Деформация полимеров Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Внутренняя среда организма. Система крови. Физико-химические свойства крови
Внутренняя среда организма. Система крови. Физико-химические свойства крови Флотационный способ обогащения
Флотационный способ обогащения Неорганическая и органическая химия
Неорганическая и органическая химия Консультация по химии
Консультация по химии Изомерия
Изомерия Произведение растворимости
Произведение растворимости Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Основания
Основания Приходченко ФЕР-2031
Приходченко ФЕР-2031 Процессы подготовки горючих ископаемых к переработке. Лекция № 2
Процессы подготовки горючих ископаемых к переработке. Лекция № 2 Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха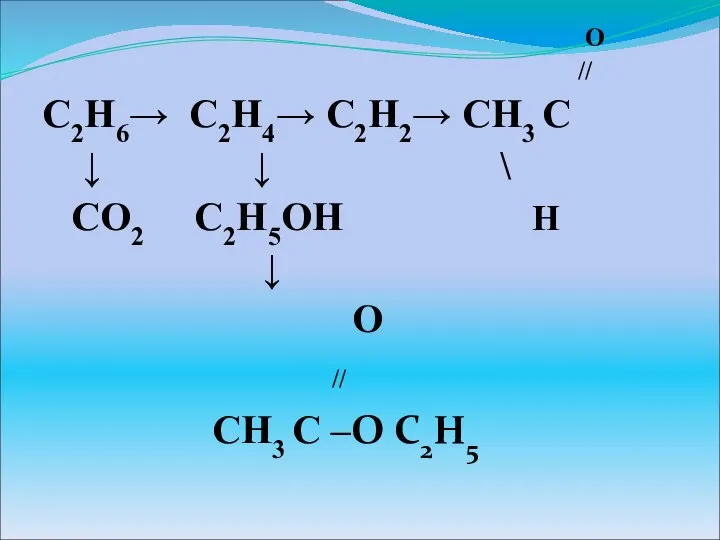 Органические соединения
Органические соединения Строение сложного фермента
Строение сложного фермента Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Белки. Структуры белков
Белки. Структуры белков Современные сплавы на основе циркония
Современные сплавы на основе циркония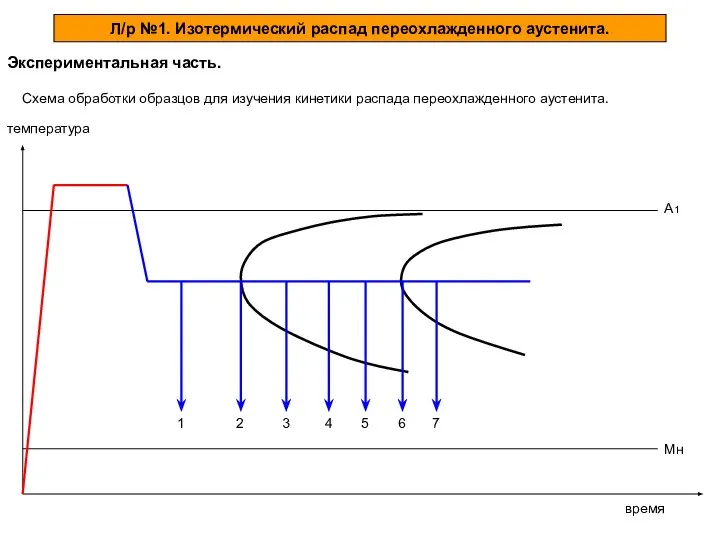 Изотермический распад переохлажденного аустенита. Экспериментальная часть
Изотермический распад переохлажденного аустенита. Экспериментальная часть Алкены
Алкены Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Reshenie_zadach
Reshenie_zadach Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Химия в жизни человека
Химия в жизни человека