Содержание
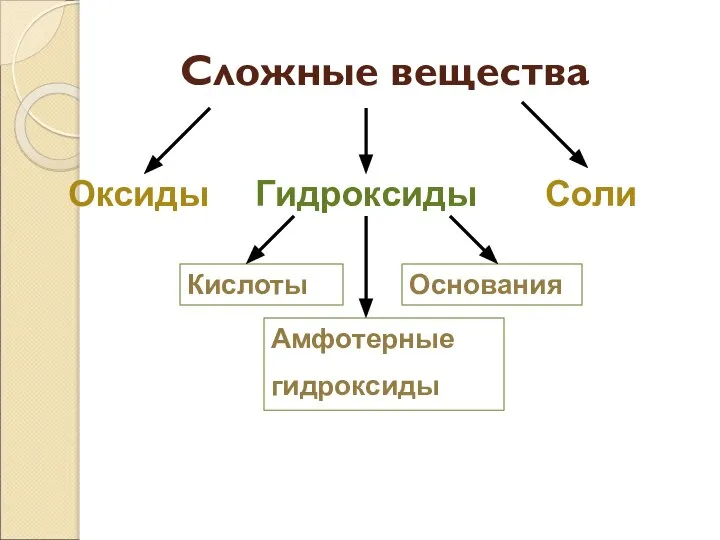
- 2. Сложные вещества Оксиды Гидроксиды Соли Кислоты Основания Амфотерные гидроксиды
- 3. Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная
- 4. Гидроксиды Гидроксиды – это неорганические соединения, содержащие в составе гидроксильную группу (-ОН ) Общая формула: Э(ОН)n
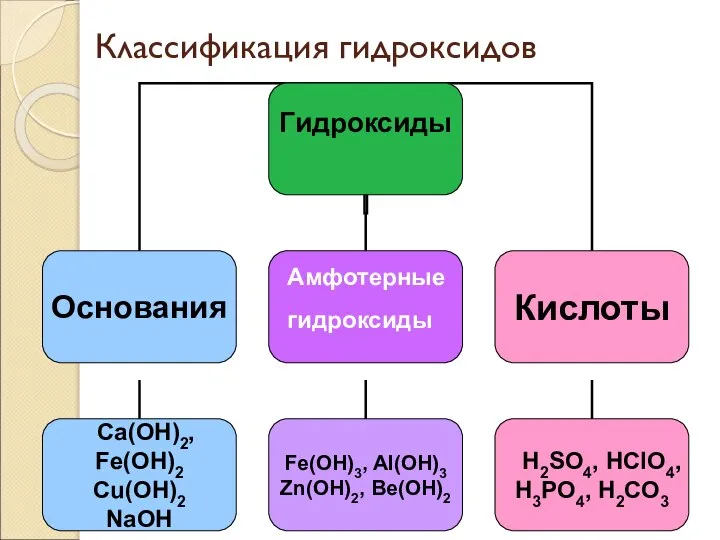
- 5. Амфотерные гидроксиды Классификация гидроксидов
- 6. Основания Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или
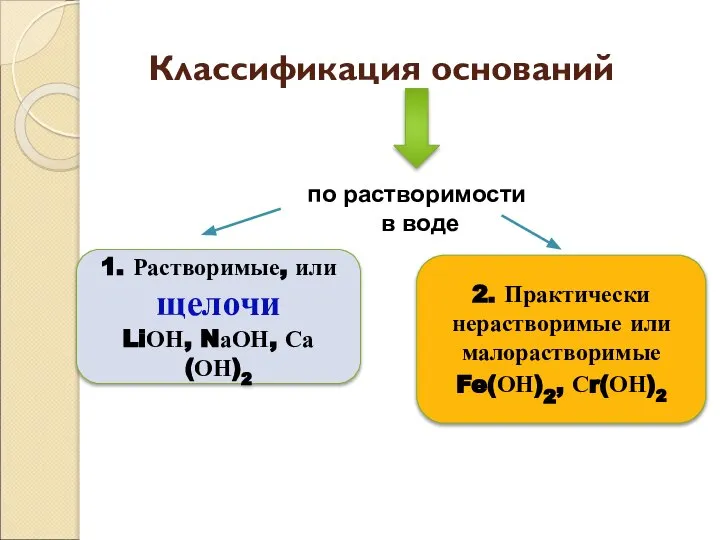
- 7. Классификация оснований по растворимости в воде 1. Растворимые, или щелочи LiОН, NаОН, Са(ОН)2 2. Практически нерастворимые
- 8. Основания. Гидроксиды щелочных металлов Общая формула – МеОН Щелочи. Белые кристаллические вещества, гигроскопичны, хорошо растворимы в
- 9. Гидроксиды металлов IIА группы Общая формула – Ме(ОН)2 Белые кристаллические вещества, в воде растворимы хуже, чем
- 10. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метилоранж – на желтый Химические
- 11. 2. Взаимодействуют со всеми кислотами (реакция нейтрализации) NaOH + HCl → NaCl + H2O 3. Взаимодействуют
- 12. 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H2O → Na2SiO3 +
- 13. Химические свойства нерастворимых оснований 1. Взаимодействуют с кислотами (реакция нейтрализации) Fe(OH) 2 + H2SO4 → FeSO4
- 14. Способы получения растворимых оснований (щелочей) 1. Взаимодействие щелочных и щелочно-земельных металлов их оксидов с водой 2Na
- 15. Способы получения нерастворимых оснований 2. Взаимодействие раствора щелочи с раствором соли 3NaOH + АlCl3 = Al(OH)3
- 16. Кислоты Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. При
- 17. Физические свойства кислот При обычных условиях кислоты могут быть жидкими и твердыми (борная, ортофосфорная, вольфрамовая) Кислоты
- 18. Классификация кислот
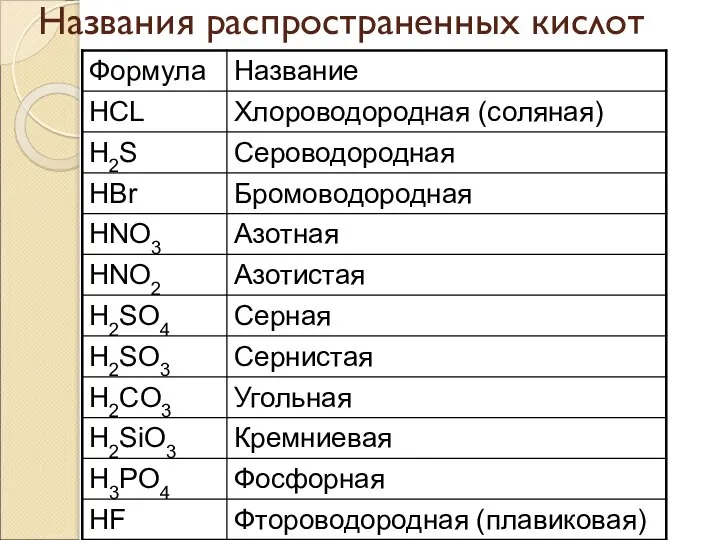
- 19. Названия распространенных кислот
- 20. Типичные реакции кислот 1. Кислота + основание = соль + вода H2SO4 +2 NaOH = Na2SO4
- 21. Типичные реакции кислот 3. Кислота + металл = водород + соль 2HCL +Zn = ZnCL2 +
- 22. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой SO3 + H2O = H2SO4; CO2 +
- 23. Амфотерными называются гидроксиды , которые в зависимости от условий могут быть как донорами катионов водорода и
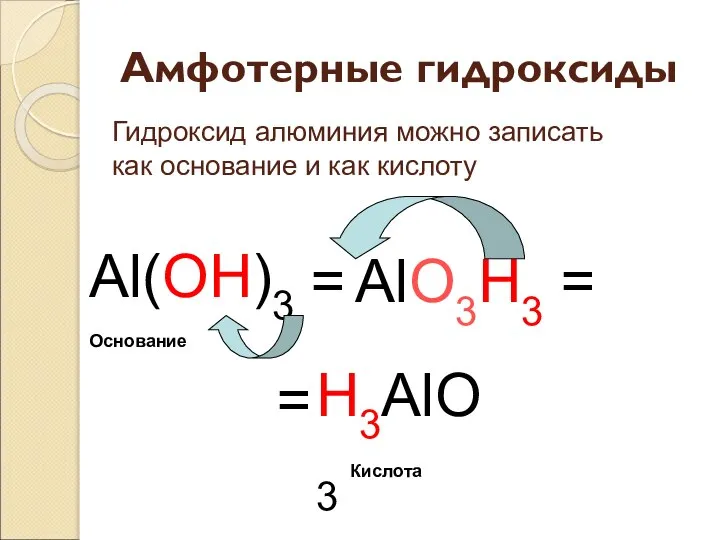
- 24. Амфотерные гидроксиды Al(OH)3 = H3AlO3 AlO3H3 = = Кислота Основание Гидроксид алюминия можно записать как основание
- 25. Некоторые гидроксиды с кислотно-основными свойствами:
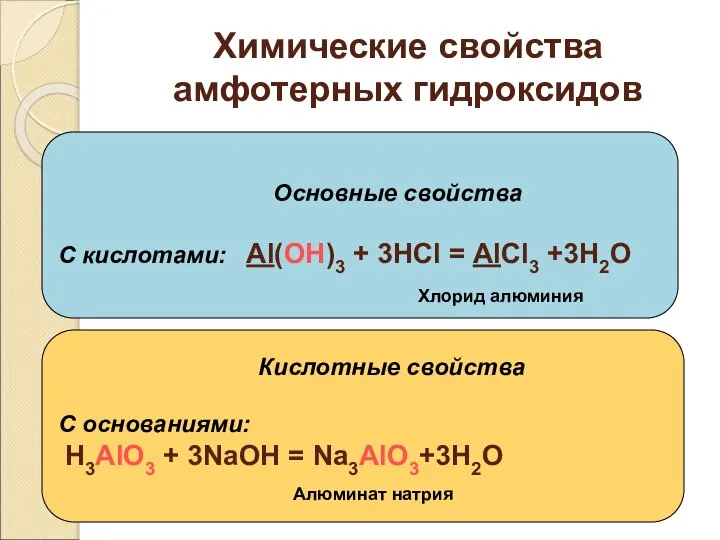
- 26. Химические свойства амфотерных гидроксидов Основные свойства С кислотами: Al(OH)3 + 3HCl = AlCl3 +3H2O Кислотные свойства
- 27. Способы получения амфотерных гидроксидов Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента AlCl3 + NаOH
- 28. 1. Из предложенного перечня веществ выберите формулы гидроксидов,,, распределите их по классам и дайте им названия:
- 30. Скачать презентацию





















 Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Лакокрасочные материалы
Лакокрасочные материалы Серная кислота
Серная кислота Химия углеводов
Химия углеводов Стекло. Определение стекла
Стекло. Определение стекла Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Энергетика хим процессов
Энергетика хим процессов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Сахар-рафинад
Сахар-рафинад Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Мышьяк (As)
Мышьяк (As) Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот teoriya_elektroliticheskoy_dissotsiatsii
teoriya_elektroliticheskoy_dissotsiatsii Карбоновые кислоты
Карбоновые кислоты Презентация на тему Химические уравнения. Реакции обмена
Презентация на тему Химические уравнения. Реакции обмена  Характеристика углерода
Характеристика углерода Химические вещества, используемые при пайке
Химические вещества, используемые при пайке Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Свойства металлов. Лекция №8
Свойства металлов. Лекция №8 Метанол. Способы получения
Метанол. Способы получения Углеводороды: номенклатура
Углеводороды: номенклатура Реактор гидроочистки дизельного топлива. Контроль и автоматизация
Реактор гидроочистки дизельного топлива. Контроль и автоматизация Водопроводная вода и её фильтрация
Водопроводная вода и её фильтрация Незаменимая уксусная кислота
Незаменимая уксусная кислота