Содержание
- 2. Физические свойства металлов Металлический блеск Серебристо-белый цвет Твердость Ковкость и пластичность (Возможность лёгкой механической обработки) ,
- 4. Химические свойства металлов С простыми веществами 1. С неметаллами
- 5. а) С водородом (+ Н2) при нагревании образуются гидриды 2Li + H2-- 2LiH гидрид лития Mg
- 6. б) с кислородом (+О2) Образуются оксиды 4Li + O2 → 2Li2O оксид лития 2Ca + O2
- 7. +O2 Со средними и малоактивными металлами реакция происходит при нагревании: 3Fe + 2O2 = Fe3O4 (FeO*Fe2O3)
- 8. С кислородом реагируют все металлы, кроме золота, платины. Au + O2 ⌦ Pt + O2 ⌦
- 9. в) с серой Образуются сульфиды Li + S ? Li2S сульфид лития С серой реагируют все
- 11. Скачать презентацию








 Кремневые породы
Кремневые породы Алкены (олефины)
Алкены (олефины) Алканы – строение, химические свойства
Алканы – строение, химические свойства Массовая доля химич элемента
Массовая доля химич элемента Алканы
Алканы Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств
Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии Этапы аналитических работ
Этапы аналитических работ Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства)
Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства) Никель и его соединения
Никель и его соединения Каучук
Каучук Химические средства защиты растений
Химические средства защиты растений Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Углеводороды. Урок-игра
Углеводороды. Урок-игра Получение антибиотиков
Получение антибиотиков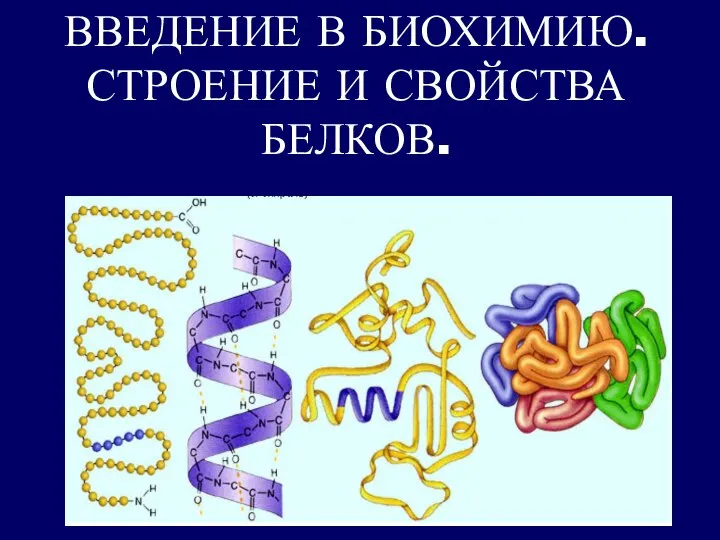 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.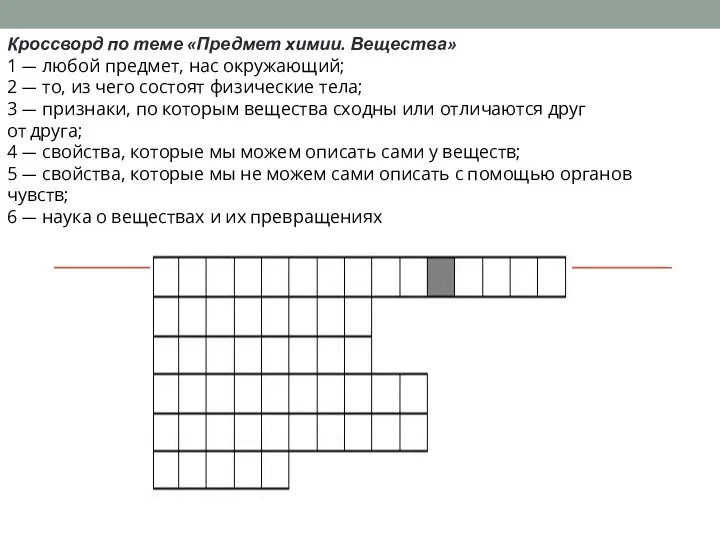 Предмет химии. Вещества
Предмет химии. Вещества Алкины. Ацетилен
Алкины. Ацетилен Юные химики. Своя игра
Юные химики. Своя игра Металлы. Химический хоккей
Металлы. Химический хоккей Основы квантовой химии
Основы квантовой химии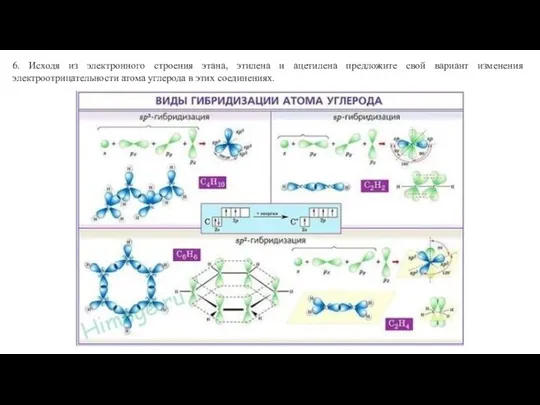 Виды гибридизации атома углерода
Виды гибридизации атома углерода Сплавы. 9 класс
Сплавы. 9 класс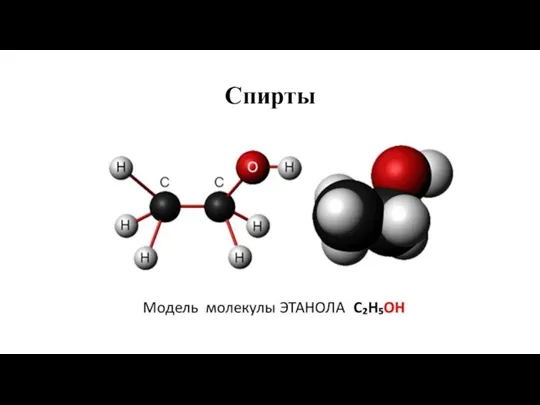 Спирты
Спирты Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"