Содержание
- 2. КОВАЛЕНТНАЯ СВЯЗЬ образуется между атомами элементов, электроотрицательности которых одинаковы или различаются не слишком сильно В зависимости
- 3. 1.6 ДПМ
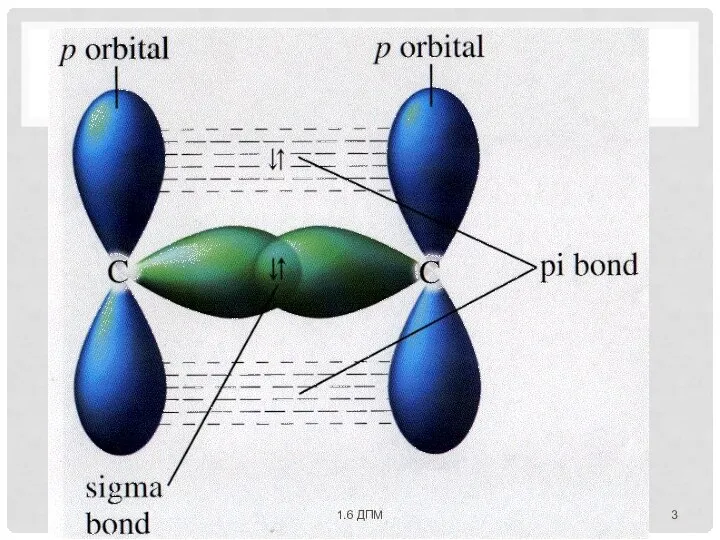
- 4. Общая электронная пара, находящаяся на π- молекулярной орбитали, из-за большого удаления от ядер соединяемых атомов слабее
- 5. 1.6 ДПМ
- 6. ДОПОЛНИТЕЛЬНЫЕ ОСОБЕННОСТИ: насыщаемость, направленность, сопряжение, полярность, поляризуемость 1.6 ДПМ
- 7. 1.НАСЫЩАЕМОСТЬ запрещается использование одной и той же орбитали дважды для образования связи (по принципу Паули) 1.6
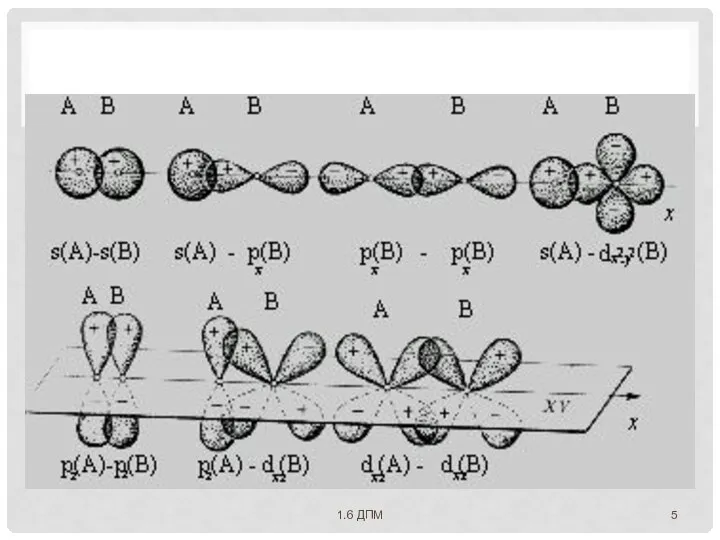
- 8. 2. НАПРАВЛЕННОСТЬ АО пространственно ориентированы вокруг ядра атома ⇒ перекрывание АО происходит по определенным направлениям ⇒
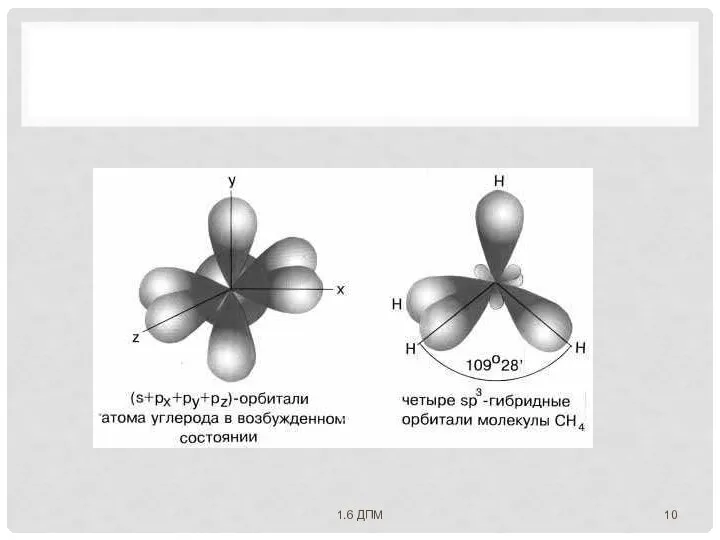
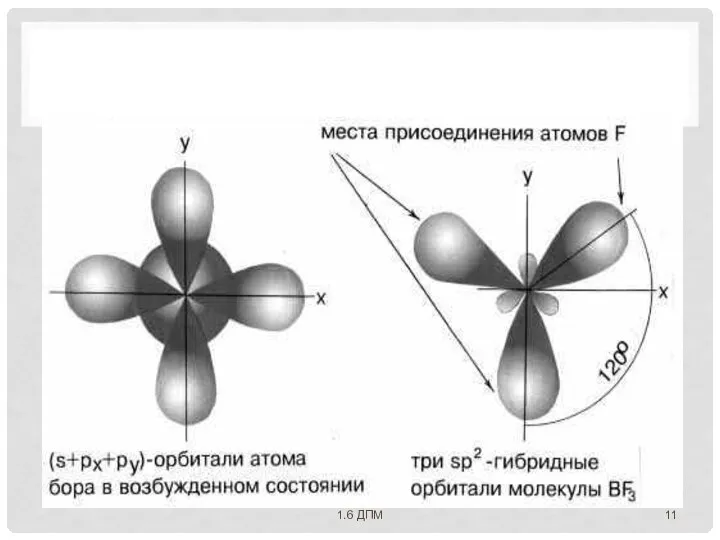
- 9. ДЛЯ ОБЪЯСНЕНИЯ ГЕОМЕТРИЧЕСКОГО СТРОЕНИЯ МОЛЕКУЛ с учетом направленности ковалентной связи Л. Полинг предложил идею о гибридизации
- 10. 1.6 ДПМ
- 11. 1.6 ДПМ
- 12. 3. СОПРЯЖЕНИЕ КОВАЛЕНТНЫХ СВЯЗЕЙ Наблюдается в молекулах и ионах, когда по обе стороны от ординарной связи
- 13. 4. ПОЛЯРНОСТЬ СВЯЗИ неполярная связь: связывающая электронная пара равномерно распределена между ядрами взаимодействующих атомов; Связь образована
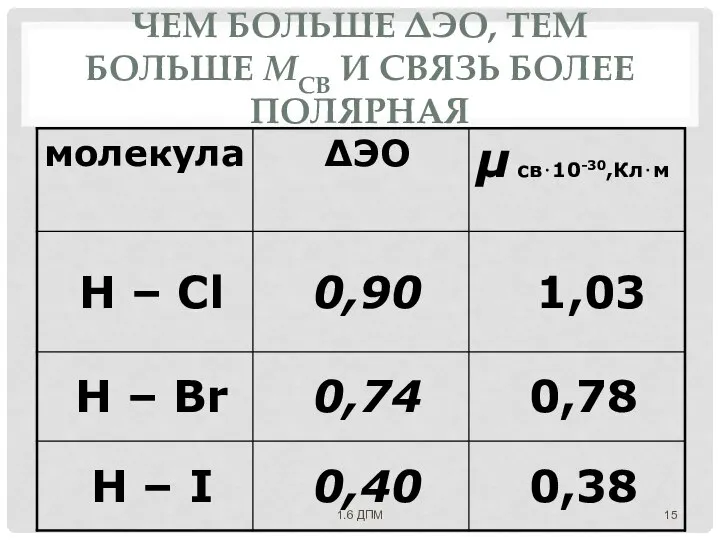
- 14. ДИПОЛЬНЫЙ МОМЕНТ μ св⋅= q·l [Кл⋅м], где заряд q полюса диполя, а l - длина диполя.
- 15. ЧЕМ БОЛЬШЕ ΔЭО, ТЕМ БОЛЬШЕ ΜСВ И СВЯЗЬ БОЛЕЕ ПОЛЯРНАЯ 1.6 ДПМ
- 16. ПОЛЯРНОСТЬ МОЛЕКУЛЫ зависит от ее геометрической структуры. Электрический момент диполя молекулы (μм)- векторная сумма электрических моментов
- 17. 5. ПОЛЯРИЗУЕМОСТЬ способность электронной плотности связи смещаться под действием внешнего электрического поля или других воздействий. Внешним
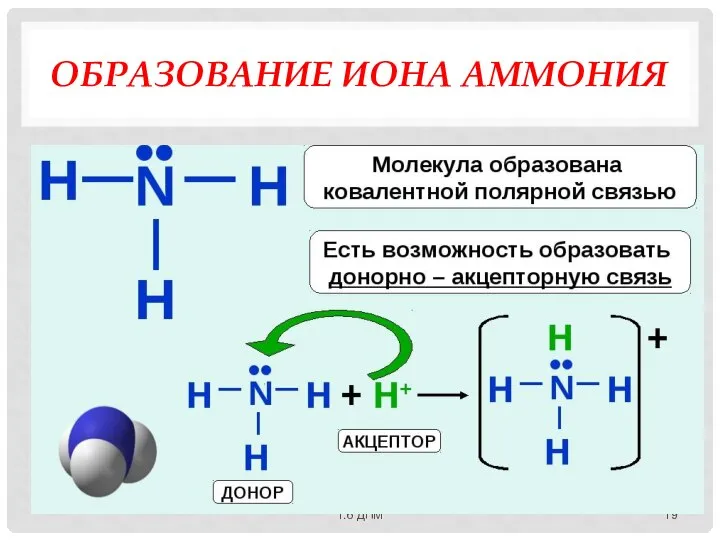
- 18. МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ: Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары
- 19. ОБРАЗОВАНИЕ ИОНА АММОНИЯ 1.6 ДПМ
- 21. Скачать презентацию








![ДИПОЛЬНЫЙ МОМЕНТ μ св⋅= q·l [Кл⋅м], где заряд q полюса диполя, а](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1019652/slide-13.jpg)



 Белый фосфор
Белый фосфор Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Характеристика углеводородов
Характеристика углеводородов Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Фосфор и его соединения. Минеральные удобрения
Фосфор и его соединения. Минеральные удобрения Полисульфидные каучуки
Полисульфидные каучуки Презентация на тему Полимеры
Презентация на тему Полимеры  Классификация неорганических соединений
Классификация неорганических соединений Неньютоновская жидкость
Неньютоновская жидкость Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Природные источники углеводородов
Природные источники углеводородов Развитие химии
Развитие химии Углеводороды
Углеводороды О́лово — элемент 14-й группы периодической системы химических элементов
О́лово — элемент 14-й группы периодической системы химических элементов Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Биологическая роль III(A) группы
Биологическая роль III(A) группы Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Zirconium Dioxide
Zirconium Dioxide смеси
смеси Vielu īpašības
Vielu īpašības Изомерия. Классификация органических веществ.
Изомерия. Классификация органических веществ. Аминокислоты
Аминокислоты Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Чистые вещества и смеси. Использование химического анализа
Чистые вещества и смеси. Использование химического анализа Hydroxidy. Vlastnosti
Hydroxidy. Vlastnosti