Содержание
- 2. Хлор — химический элемент с атомным номером 17. При нормальных условиях хлор – ядовитый удушающий газ
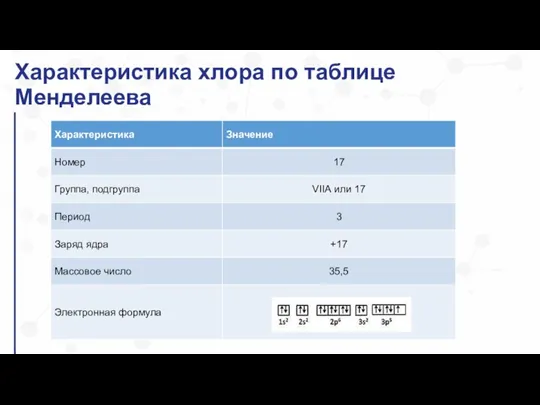
- 3. Характеристика хлора по таблице Менделеева
- 4. Химические свойства хлора Хлор очень активен - он непосредственно соединяется почти со всеми элементами периодической системы,
- 5. Возбуждённое состояние В = 1 В = 3 В = 5 В = 7
- 6. Химические свойства хлора 1. Взаимодействие с водородом – активно реагирует на свету или при нагревании (иногда
- 7. Химические свойства хлора 3. Взаимодействие с неметаллами – напрямую с углеродом, азотом и кислородом хлор не
- 8. Химические свойства хлора 4. Взаимодействие с водой – при взаимодействии диспропорционирует, образуя хлорноватистую и соляную кислоты
- 9. Задание №1 Уравняйте следующую реакцию методом электронного баланса: NaOH + Cl2 = NaCl + NaClO3 +
- 10. Химические свойства хлора 6. Взаимодействие с солями других галогенов (Br, I) – более активный галоген может
- 11. Химические свойства хлора 8. Взаимодействие с сухим гидроксидом кальция (Ca(OH)2) – получается хлорная известь: Cl2 +
- 12. Задание №2 Определите, с какими из следующих веществ будет реагировать хлор: С H2O Na N2 HI
- 13. Хлорная вода – водный раствор хлора, который содержит смесь соляной и хлорноватистой кислот (HCl + HClO)
- 14. Получение хлора в промышленности Химические методы получения хлора малоэффективны и затратны. Метод Шееле: MnO2 + 4HCl
- 15. Получение хлора в лаборатории В лабораторной практике обычно используется сжиженный хлор в баллонах. Действие кислоты на
- 16. Задание №3 Уравняйте следующую реакцию методом электронного баланса: KMnO4 + HCl = KCl + MnCl2 +
- 17. Хлор используется для обеззараживания воды, производства соляной кислоты, а также пластмасс, каучуков, растворителей, красителей. Поваренная соль
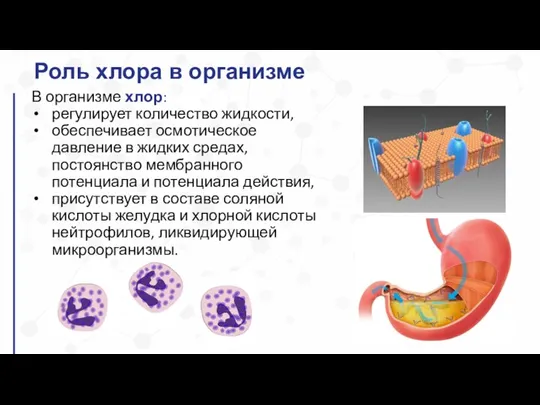
- 18. В организме хлор: регулирует количество жидкости, обеспечивает осмотическое давление в жидких средах, постоянство мембранного потенциала и
- 19. Задание №4 Известно, что в концентрация соляной кислоты в желудке составляет порядка 0,4-0,5 %. Определите, какое
- 20. Минералы, содержащие хлор бишофит MgCl2 · 6H2O карналлит KCl · MgCl2 · 6Н2O каинит KCl ·
- 21. Задание №5 Определите массовое содержание хлора в карналите (KCl · MgCl2 · 6Н2O) Решение Мr (KCl
- 22. Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну, впервые применен
- 24. Скачать презентацию



















 Кислородосодержащие органические соединения. Cпирты (алканолы)
Кислородосодержащие органические соединения. Cпирты (алканолы) Неметаллы. 8 класс
Неметаллы. 8 класс Минералы. Определения, понятия
Минералы. Определения, понятия Органическая химия. Органические вещества
Органическая химия. Органические вещества Понятие о скорости химической реакции
Понятие о скорости химической реакции Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Виды химической связи
Виды химической связи Из опыта формирования и развития универсальных учебных действий на уроках химии
Из опыта формирования и развития универсальных учебных действий на уроках химии Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Адсорбционные материалы. Цеолиты
Адсорбционные материалы. Цеолиты Экстракция
Экстракция Презентация на тему Свойства простых веществ
Презентация на тему Свойства простых веществ  Простые вещества
Простые вещества Презентация по Химии "Биотрансформация чужеродных соединений в организме"
Презентация по Химии "Биотрансформация чужеродных соединений в организме"  Соли
Соли Фосфор туралы
Фосфор туралы Энергетическая диаграмма орбиталей многоэлектронного атома
Энергетическая диаграмма орбиталей многоэлектронного атома Опасная бытовая химия!
Опасная бытовая химия! Образование химических соединений с учетом валентности элементов
Образование химических соединений с учетом валентности элементов Карбоновые кислоты
Карбоновые кислоты Щелочноземельные металлы
Щелочноземельные металлы Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах
Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах  Использование комплексно-ориентированных заданий на уроках
Использование комплексно-ориентированных заданий на уроках Золоторудное поле Дуэт
Золоторудное поле Дуэт Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки
Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений