Содержание
- 2. 1) Кремний и древесный уголь самовоспламеняются во фторе. 2) В состав зубной эмали входит до 0,02
- 3. 1) Кадмий — мягкий ковкий серебристо-серый металл 2) На воздухе кадмий устойчив и не утрачивает металлического
- 4. Число электронов на внешнем энергетическом уровне: класс вещества Число электронов на внешнем уровне определю по подгруппе
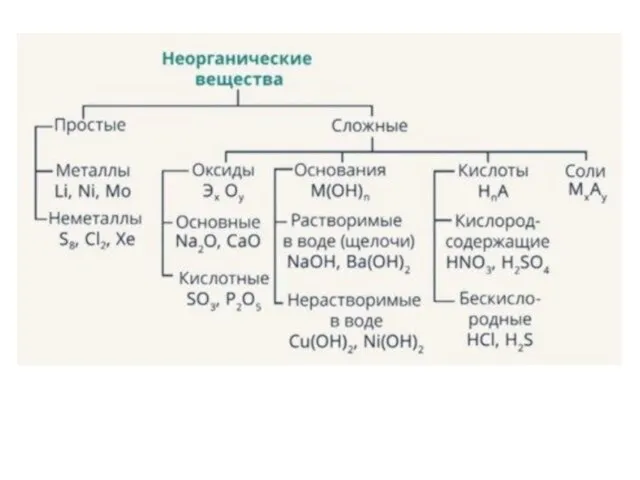
- 5. Свойства веществ зависят от валентных электронов Для металлов: Основные (1-2) Амфотерные (2-4) Кислотные Для неметаллов: несолеобразующиеоксиды
- 7. Алгоритм написания формулы и определения класса 1.Строю формулу валентного уровня вещества и определяю валентные электроны в
- 8. Силикат цинка — химическое соединение ZnSiO3, используется при производстве флуоресцентных экранов. Вычислите в процентах массовую долю
- 9. Сульфат лития — химическое соединение Li2SO4, используется для изготовления приёмников ультразвука. Вычислите в процентах массовую серы
- 10. Карбонат натрия — химическое соединение Na2CO3, используется для получения пигмента ультрамарина. Вычислите в процентах массовую долю
- 11. Скорость химических реакций
- 12. Некоторые понятия химической кинетики. Химическая кинетика – раздел химии, изучаю- щий скорость и механизмы химических реакций.
- 13. Что такое химические реакции? Химические реакции – превращения одних веществ в другие, отличающиеся по составу и
- 14. Химические реакции протекают с разными скоростями. Быстрые реакции протекают в водных растворах с участием растворимых веществ;
- 15. Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени: Скорость гетерогенной реакции
- 16. Факторы, влияющие на скорость химической реакции. Природа реагирующих веществ Температура Концентрация реагирующих веществ Наличие катализатора (ингибитора)
- 17. В случае c HCl реакция пойдет быстрее, т.к. соляная кислота – сильная, а уксусная – слабая.
- 18. Температура Правило Вант-Гоффа: Повышение температуры на каждые 10 °С приводит к увеличению скорости реакции в 2–4
- 19. Пример 1: Если температурный коэффициент реакции равен 2, то при повышении температуры с 200С до 500С
- 20. Концентрация реагирующих веществ Математически зависимость скорости от концентрации для реакции выражается законом действующих масс. Т.е. скорость
- 21. Концентрация реагирующих веществ 2SO2 + О2 ⬄ 2 SO3 + Q Пример: Если в реакции давление
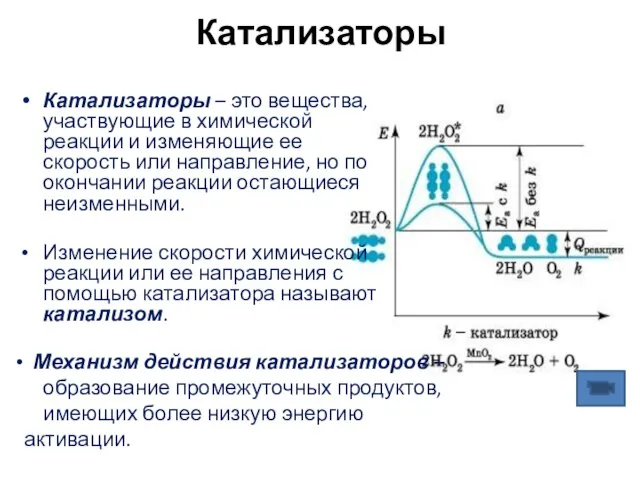
- 22. Катализаторы Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но
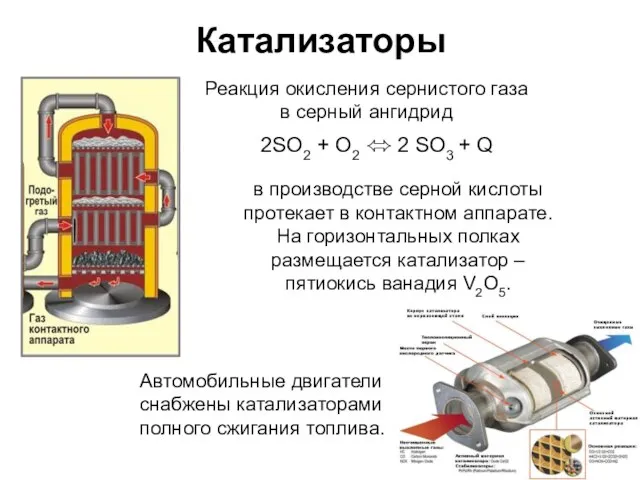
- 23. Катализаторы 2SO2 + О2 ⬄ 2 SO3 + Q Реакция окисления сернистого газа в серный ангидрид
- 24. Катализаторы Ферменты – биологически активные катализаторы. Используются в производстве детского питания, сыров, хлебопечении, виноделии и пивоварении.
- 25. Площадь соприкосновения реагирующих веществ В каком случае реакция пойдет с бОльшей скоростью: Feкусковое + HCl ?
- 27. Скачать презентацию




















 Силикаты
Силикаты Презентация на тему Сложные вопросы ЕГЭ по химии
Презентация на тему Сложные вопросы ЕГЭ по химии  Строение электронных оболочек
Строение электронных оболочек Vvedenie_v_khimiyu
Vvedenie_v_khimiyu Адсорбция. Адсорбент
Адсорбция. Адсорбент Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Сложные эфиры. Жиры
Сложные эфиры. Жиры Опасные химические вещества и их поражающее действие на организм человека
Опасные химические вещества и их поражающее действие на организм человека Применение брома
Применение брома Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Важнейшие соединения хлора
Важнейшие соединения хлора Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Химическая промышленность
Химическая промышленность Смеси веществ
Смеси веществ Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13
Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения kristallichekaya_reshenka_vidy
kristallichekaya_reshenka_vidy Проблемы и меры по защите окружающей среды ПМР
Проблемы и меры по защите окружающей среды ПМР Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В.
Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В. Ferrum железо
Ferrum железо Круговорот серы в природе
Круговорот серы в природе Химическая термодинамика
Химическая термодинамика Открытия в химии
Открытия в химии Химические свойства производных бензола с непредельного ряда радикалом
Химические свойства производных бензола с непредельного ряда радикалом Вывод химических формул
Вывод химических формул