Содержание
- 2. «Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки».
- 3. С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
- 4. Необходимые навыки Расстановка степеней окисления Задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а
- 5. Последовательность расстановки коэффициентов в уравнении Сначала проставьте коэффициенты, полученные из электронного баланса Если какое-либо вещество выступает
- 6. Возможные ошибки Расстановка степеней окисления: а) степени окисления в водородных соединениях неметаллов: фосфин РН3 — степень
- 7. 2. Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель
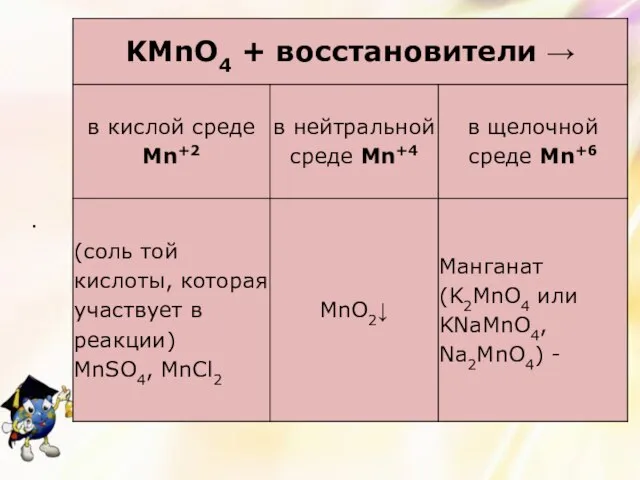
- 8. .
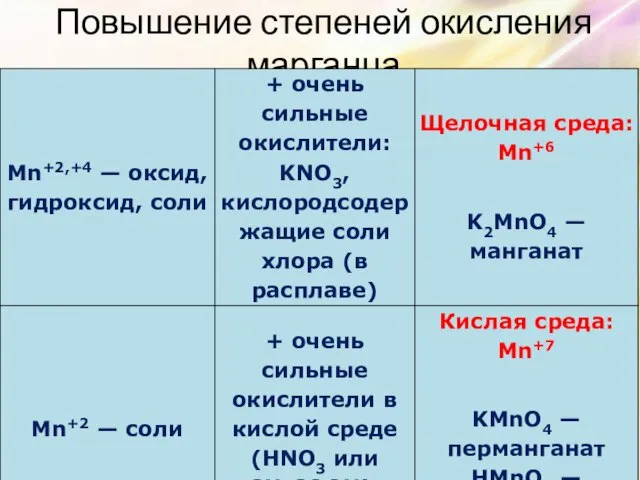
- 9. Повышение степеней окисления марганца
- 10. Дихромат и хромат как окислители.
- 11. Повышение степеней окисления хрома
- 12. Азотная кислота с металлами. — не выделяется водород, образуются продукты восстановления азота
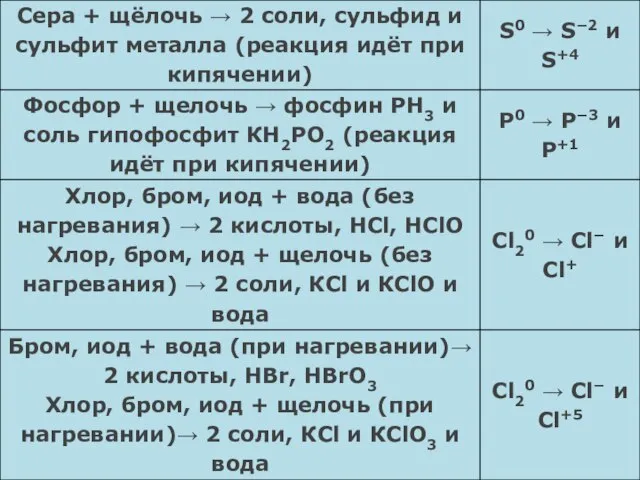
- 13. Диспропорционирование Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем,
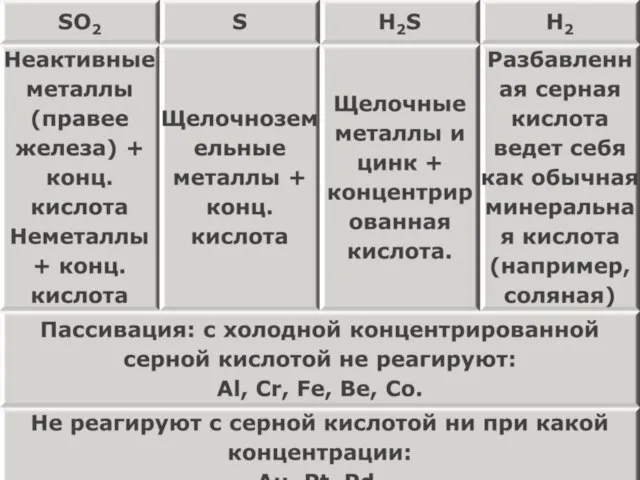
- 14. Серная кислота с металлами — разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее
- 15. Диспропорционирование оксида азота (IV) и солей.
- 16. С 2. Взаимосвязь различных классов неорганических веществ Изменения в КИМ 2012 года
- 17. Задание С2 предложено в двух форматах. В одних вариантах КИМ оно будет предложено в прежнем формате
- 18. С2.1. (ПРЕЖНИЙ ФОРМАТ) – 4 БАЛЛА. ДАНЫ ВЕЩЕСТВА: ОКСИД АЗОТА (IV), МЕДЬ, РАСТВОР ГИДРОКСИДА КАЛИЯ И
- 19. 1 или 2 реакции обычно «лежат на поверхности», демонстрируя либо кислотные, либо основные свойства вещества В
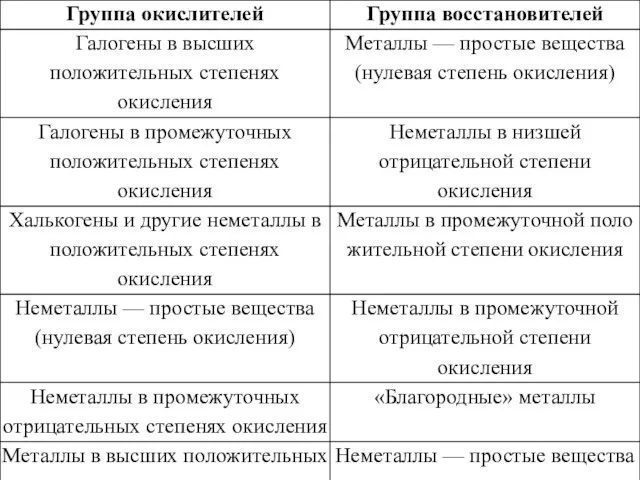
- 20. Типичные окислители и восстановители в порядке ослабления окислительных и восстановительных свойств
- 21. Даны четыре вещества: оксид азота (IV), иодоводород, раствор гидроксида калия, кислород. 1. кислота + щёлочь а)
- 22. С 3. Генетическая связь между основными классами органических веществ
- 23. Общие свойства классов органических веществ Общие способы получения органических веществ Специфические свойства некоторых конкретных веществ Обязательный
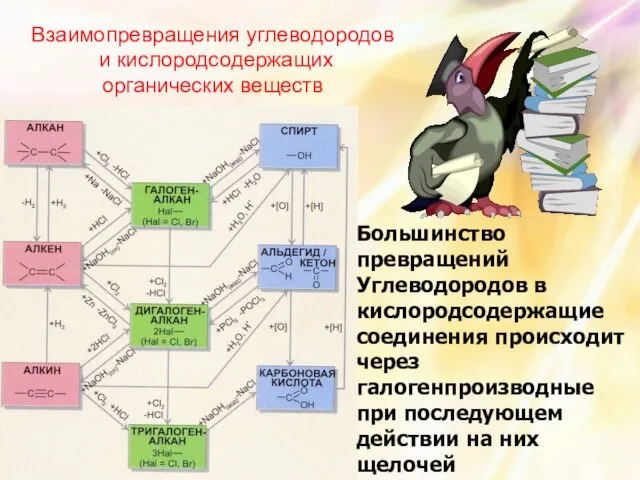
- 24. Большинство превращений Углеводородов в кислородсодержащие соединения происходит через галогенпроизводные при последующем действии на них щелочей Взаимопревращения
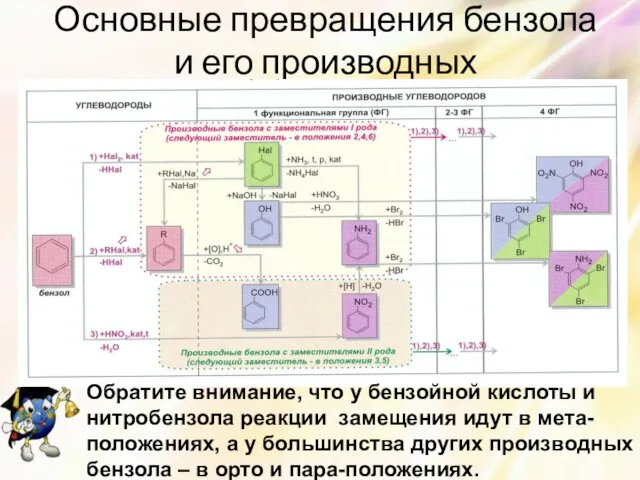
- 25. Основные превращения бензола и его производных Обратите внимание, что у бензойной кислоты и нитробензола реакции замещения
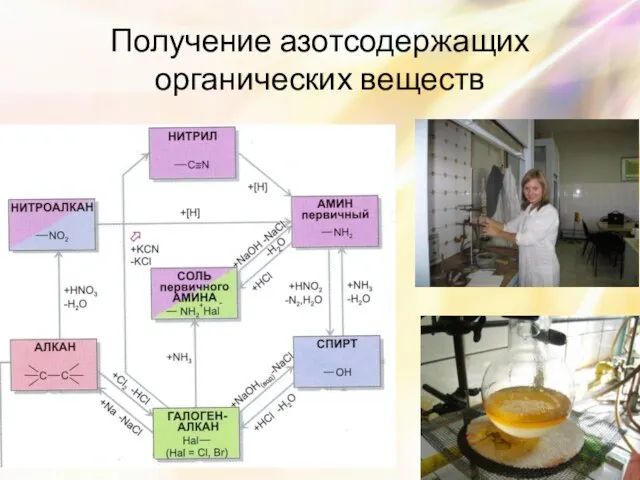
- 26. Получение азотсодержащих органических веществ
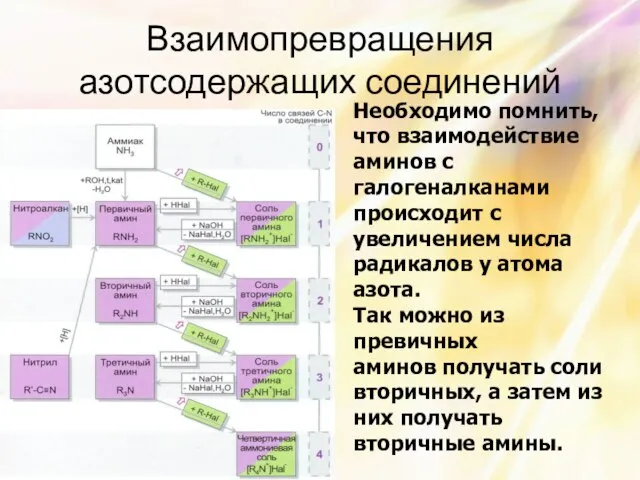
- 27. Взаимопревращения азотсодержащих соединений Необходимо помнить, что взаимодействие аминов с галогеналканами происходит с увеличением числа радикалов у
- 28. Окислительно-восстановительные свойства кислородсодержащих соединений Окислителями спиртов чаще всего являются оксид меди (II) или перманганат калия, а
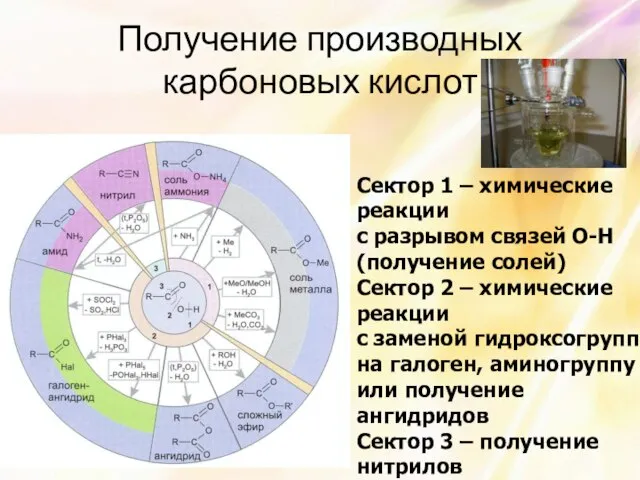
- 29. Получение производных карбоновых кислот Сектор 1 – химические реакции с разрывом связей О-Н (получение солей) Сектор
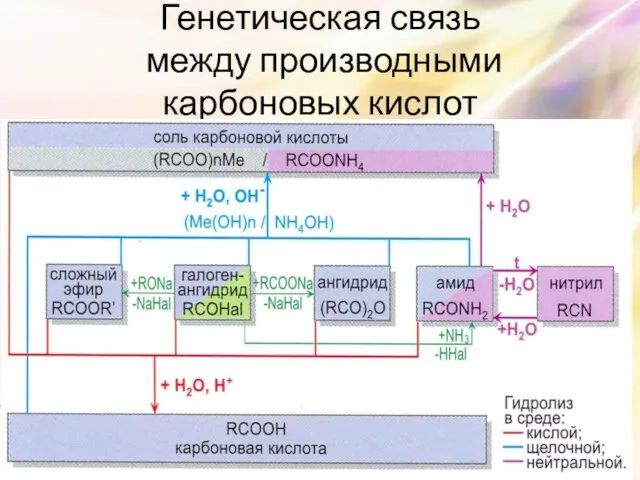
- 30. Генетическая связь между производными карбоновых кислот
- 31. Типичные ошибки при выполнении задания СЗ: незнание условий протекания химических реакций, генетической связи классов органических соединений;
- 32. С 4. Расчёты по уравнениям реакций
- 33. Классификация задач
- 34. Расчёты по уравнениям реакций. Газ, выделившийся при взаимодействии 110 мл 18 % -ного раствора HCl (ρ
- 35. II. Задачи на смеси веществ На нейтрализацию 7,6 г смеси муравьиной и уксусной кислот израсходовано 35
- 36. III. Определение состава продукта реакции (задачи на «тип соли») Аммиак объёмом 4,48 л (н.у) пропустили через
- 37. IV. Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса Оксид, образовавшийся
- 38. Нахождение массы одного из исходных веществ по уравнению материального баланса Какую массу гидрида лития нужно растворить
- 39. Наиболее часто учащимися допускаются ошибки: - при определении массы раствора без учета массы выделившегося газа или
- 40. С 5. Вывод молекулярной формулы вещества
- 41. Вывод формул
- 43. Установите молекулярную формулу предельного третичного амина, содержащего 23,73% азота по массе.
- 44. 2. При монохлорировании углеводорода, содержащего 83, 72 % углерода образовалось два изомерных хлорпроизводных – первичное и
- 45. 3. На нейтрализацию 18,5 г предельной одноосновной карбоновой кислоты потребовался раствор, содержащий 10 г гидроксида натрия.
- 46. 4. Одно и то же количество алкена при взаимодействии с хлором образует 2,26 г дихлорпроизводного, а
- 47. 5. При сгорании вторичного амина симметричного строения образовалось 44,8 мл углекислого газа, 5,6 мл азота (при
- 48. Спасибо за внимание
- 50. Скачать презентацию




































 Относительная атомная масса элементов
Относительная атомная масса элементов Общая характеристика элементов главной подгруппы II группы
Общая характеристика элементов главной подгруппы II группы Вклад учёных-химиков в Великую победу
Вклад учёных-химиков в Великую победу Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Соединения железа
Соединения железа Тайна алмазов
Тайна алмазов Кроссворд. Плотность
Кроссворд. Плотность Хладостойкие неметаллические материалы
Хладостойкие неметаллические материалы Закон сохранения массы веществ. 8 класс
Закон сохранения массы веществ. 8 класс Кислоты и их свойства
Кислоты и их свойства Химия. Решение задач
Химия. Решение задач Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Проектная работа по химии «Жидкий азот» Выполнили учащиеся 10Б класса Лобакин А. и Тумаков И.
Проектная работа по химии «Жидкий азот» Выполнили учащиеся 10Б класса Лобакин А. и Тумаков И. Основания. Химические свойства.получение
Основания. Химические свойства.получение Искусственные полимеры
Искусственные полимеры Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Ogļūdeņražu karboksilatvasinājumi
Ogļūdeņražu karboksilatvasinājumi Сурьма, Sb
Сурьма, Sb Жидкое состояние вещества
Жидкое состояние вещества Основы химической термодинамики
Основы химической термодинамики Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2 Бутадиен-стирольный каучук. 10 класс
Бутадиен-стирольный каучук. 10 класс Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Шаблон презентации по химии
Шаблон презентации по химии Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Путешествие в мир удивительных веществ Оксиды. Химия 8 класс
Путешествие в мир удивительных веществ Оксиды. Химия 8 класс Кислород
Кислород Металлы. Кроссворд
Металлы. Кроссворд