карбоновых кислот — сплавление со щелочами)
Реакция Кольбе (электролиз растворов солей карбоновых кислот):
Реакция Вюрца–Фиттига (получение гомологов бензола из галогенбензола):
C6H5–Br+2Na+Br–CH3⟶C6H5–CH3+2NaBr
Реакция Кучерова (гидратация алкинов):
Реакция Зелинского (тримеризация ацетилена)
Реакция Зелинского–Казанского (получение бензола из циклогексана):
C6H12→420–480∘C,Pd,PtC6H6+3H2
Реакция Коновалова (нитрование алканов):
CH3–CH2–CH3+HNO2→110–140∘CCH3–CH(NO2)–CH3+H2O
Реакция Зинина (восстановление нитробензола до анилина):
C6H5–NO2⟶[H]C6H5–NH2+2H2O
Реакция Густавсона (получение циклоалкана из дигалогенопроизводных):
Реакция Фриделя–Крафтса (алкилирование бензола):
C6H6+Cl–CH3⟶AlCl3C6H5–CH3+HCl
C6H6+H2C=CH2⟶AlCl3C6H5–CH2–CH3
C6H6+H2C=CH–CH3⟶AlCl3C6H5–CH(CH3)–CH3
Реакция Прилежаева (каталитическое окисление этилена с получением эпоксида):
Реакция Вагнера (мягкое окисление алкенов):
CH3–CH=CH2+H2O+[O]→20∘C,KMnO4H3C–CH(OH)–CH2–OH
Реакция Лебедева (получение бутадиена-1,3):
Chem_Bio_As














 Карбоцепные полимеры
Карбоцепные полимеры 9-14 Реакции в растворах электролитов
9-14 Реакции в растворах электролитов Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Химическое равновесие
Химическое равновесие Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Ovr-1
Ovr-1 Металлургия
Металлургия Теория строения органических соединений
Теория строения органических соединений Предмет химии. Вещества
Предмет химии. Вещества Основы химии полимеров
Основы химии полимеров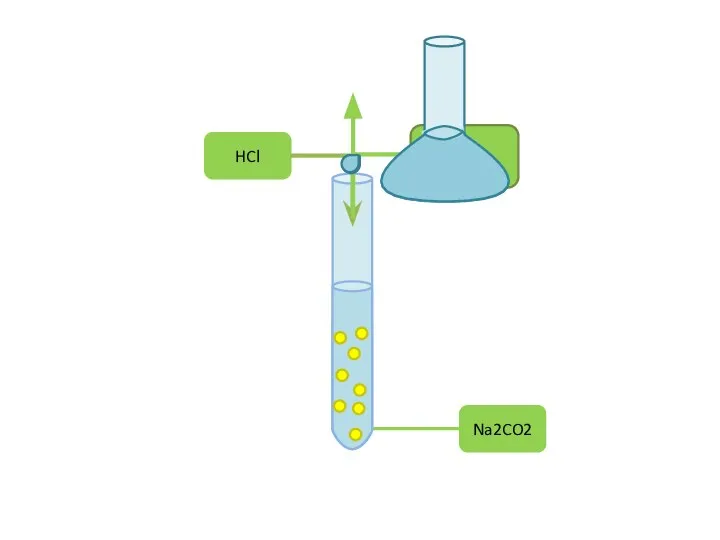 Хімічний експеримент
Хімічний експеримент Теплота растворения
Теплота растворения Арены. Бензол
Арены. Бензол 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr Аммиак. Соли аммония
Аммиак. Соли аммония Альдегиды и кетоны
Альдегиды и кетоны Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Образование химических связей
Образование химических связей Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Харктеристика металлов
Харктеристика металлов Презентация на тему Сложные вопросы ЕГЭ по химии
Презентация на тему Сложные вопросы ЕГЭ по химии  Валентность
Валентность Substanță chimică
Substanță chimică Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Неметаллические материалы
Неметаллические материалы Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества