Содержание
- 2. Цель урока: Рассмотреть 1. Электронное строение атома железа, дать общую характеристику его. 2. Физические и химические
- 3. Нахождение в природе Метеоритное железо
- 4. Природные соединения железа Fe FeS Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3.3H2O Лимонит (бурый железняк)
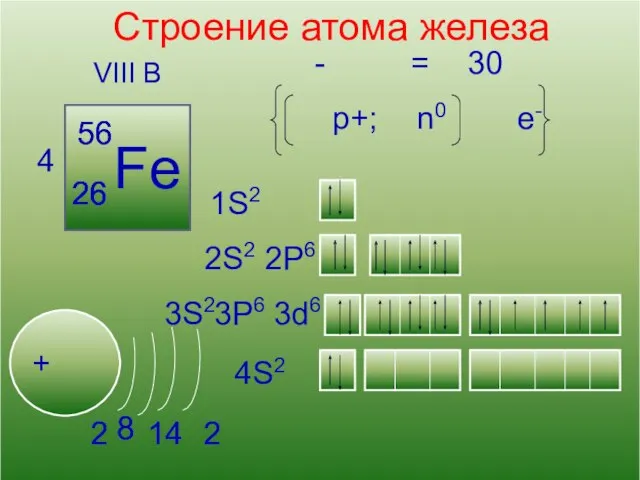
- 6. 13 Кислород Строение атома железа VIII B 4 Fe + 56 26 2S2 1S2 2P6 3S2
- 7. Физические свойства железа Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к намагничиванию. Плотность 7,864г/см3,
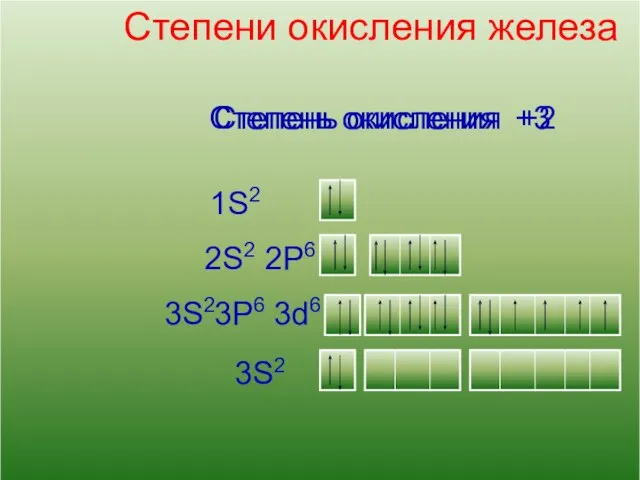
- 8. 13 Кислород Степени окисления железа 2S2 1S2 2P6 3S2 3d6 3P6 3S2 Степень окисления +2 Степень
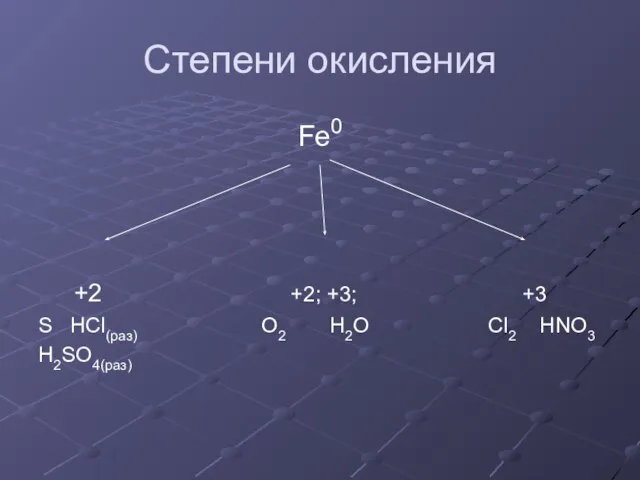
- 9. Степени окисления Fe0 +2 +2; +3; +3 S HCl(раз) O2 H2O Cl2 HNO3 H2SO4(раз)
- 10. Получение железа FeO + C = Fe + CO t˚ Fe3O4 + 4CO = 3Fe +
- 11. Химические свойства железа Взаимодействие железа с кислородом: Fe + O2 = Fe3O4 (FeO.Fe2O3) 3 2
- 12. Химические свойства железа Взаимодействие железа с хлором: Fe + Cl2 = FeCl3 2 3 2
- 13. Химические свойства При нагревании Fe +S =FeS При очень высокой температуре 4Fe + 3C =Fe4C3 4Fe
- 14. Химические свойства Fe + CuSO4 = Cu + FeSO4 Fe + 2HClр = FeCl2 + H2
- 15. При нагревании 2Fe+6H2SO4=Fe2(SO4)3+3SO2+6H2O конц Fe+6HNO3=Fe(NO3)3+ 3NO2+ 3H2O конц
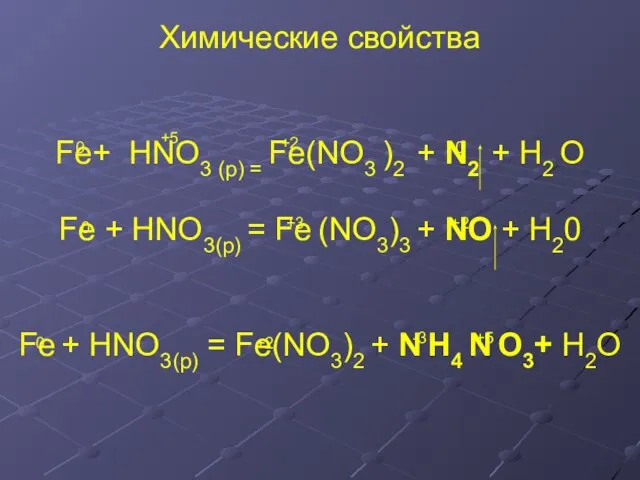
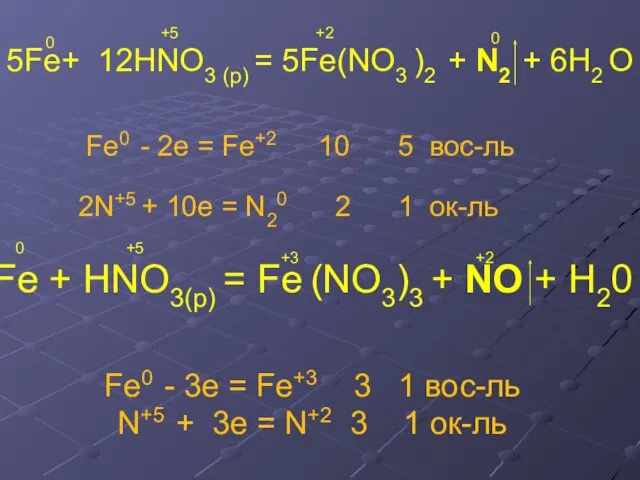
- 16. Химические свойства Fe+ HNO3 (p) = Fe(NO3 )2 + N2 + H2 O Fe + HNO3(р)
- 17. 5Fe+ 12HNO3 (p) = 5Fe(NO3 )2 + N2 + 6H2 O Fe0 - 2e = Fe+2
- 18. Fe0 - 2e = Fe+2 8 4 N+5 + 8e = N-3 2 1 ок-ль Fe
- 19. Качественные реакции на катионы железа K3[Fe(CN)6]—красная кровяная соль K4[Fe(CN)6]– желтая кровяная соль FeCl2+K3[Fe(CN)6]= KFe[Fe(CN)6] +KCl синий
- 20. Применение Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали) Железный колчедан – для
- 21. Железо необходимо для нашего организма Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
- 22. 1. Сколько d электронов содержит атом железа? 1) 26 2) 8 3) 6 4) 56 2.
- 23. 1. Сколько электронов содержит атом железа? 26 2) 8 3) 4 4) 56 2. При взаимод.
- 24. Домашнее задание Параграф 14 Упр 4
- 26. Скачать презентацию












![Качественные реакции на катионы железа K3[Fe(CN)6]—красная кровяная соль K4[Fe(CN)6]– желтая кровяная соль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/915256/slide-18.jpg)





 Альдегиды
Альдегиды KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ;
KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ; Процессы и агрегаты нефтегазовых технологий
Процессы и агрегаты нефтегазовых технологий Алхимики в Средние века
Алхимики в Средние века Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Предмет органической химии
Предмет органической химии Курсовая работа. Синтез адипиновой кислоты
Курсовая работа. Синтез адипиновой кислоты Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Алкины
Алкины Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Кремень – камень
Кремень – камень Строение электронных оболочек атомов
Строение электронных оболочек атомов Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Шухов Владимир Григорьевич (1853–1939)
Шухов Владимир Григорьевич (1853–1939) Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Презентация на тему Химические волокна
Презентация на тему Химические волокна  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Валентные возможности атомов элементов
Валентные возможности атомов элементов Оксиды. 8 класс
Оксиды. 8 класс Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,
Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,  Основные понятия физической химии
Основные понятия физической химии Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии