Содержание
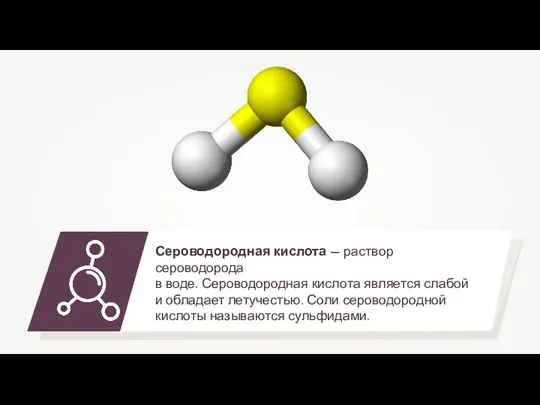
- 2. Сероводород также имеет лечебное значение, он является составной частью некоторых минеральных вод (Пятигорск, Серноводск, Мацеста).
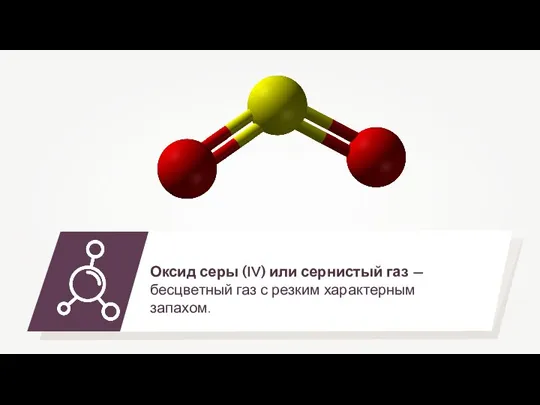
- 6. Горение сероводорода 2H2S + O2 = 2H2O + 2S↓ Горение сероводорода в недостатке кислорода: Горение сероводорода
- 8. Типы солей сернистой кислоты Na2SO3, BaSO3 Сернистая кислота — это слабая двухосновная кислота, ей соответствуют два
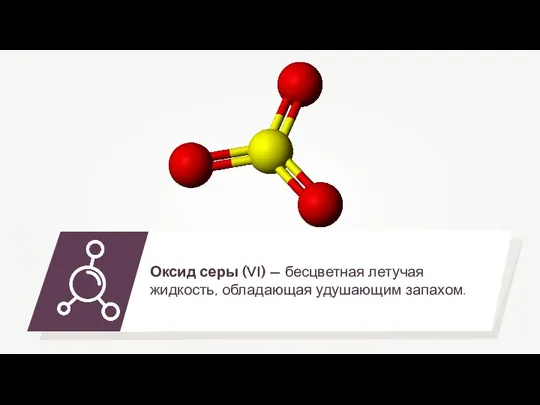
- 9. Взаимодействие сернистого газа с кислородом 2SO2 + O2 = 2SO3
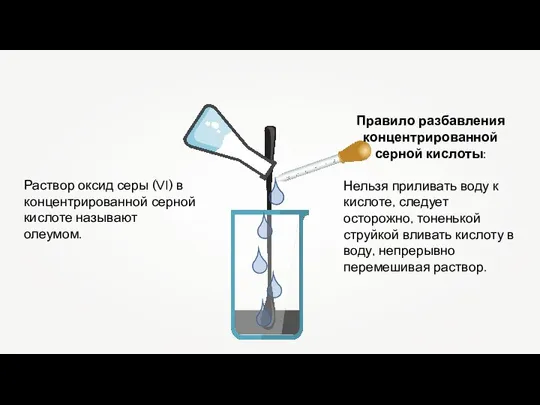
- 12. Раствор оксид серы (VI) в концентрированной серной кислоте называют олеумом. Правило разбавления концентрированной серной кислоты: Нельзя
- 13. Химические свойства разбавленной серной кислоты 3H2SO4 + 2Al = Al2(SO4)3 + 3H2↑ Взаимодействует с металлами, стоящими
- 14. Химические свойства разбавленной серной кислоты H2SO4 + 2NaOH = Na2SO4 + 2H2O Реагирует с основаниями: Взаимодействует
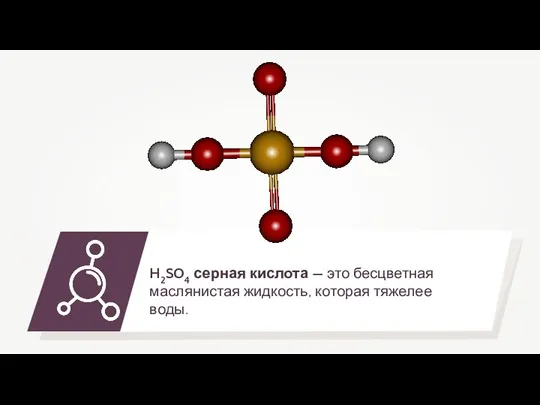
- 15. Серная кислота является двухосновной кислотой, поэтому ей соответствуют два типа солей: K2SO4, CaSO4 Средние — сульфаты:
- 16. Для качественного обнаружения серной кислоты и её солей чаще всего используют BaCl2. В результате серная кислота
- 17. Химические свойства концентрированной серной кислоты 2H2SO4 + Cu = CuSO4 + 2H2O + SO2↑ Способна взаимодействовать
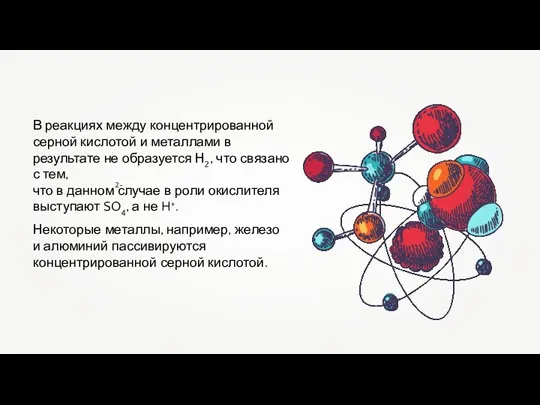
- 18. В реакциях между концентрированной серной кислотой и металлами в результате не образуется Н2, что связано с
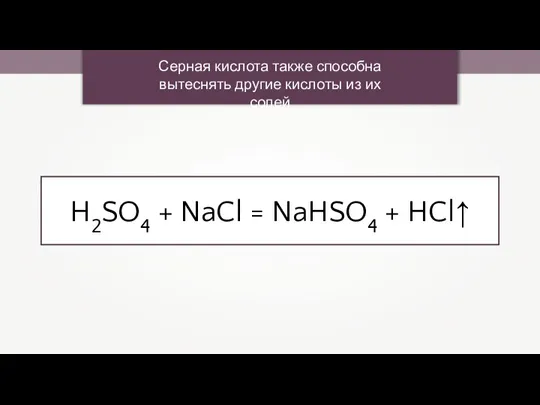
- 19. Серная кислота также способна вытеснять другие кислоты из их солей H2SO4 + NaCl = NaHSO4 +
- 20. Применение серной кислоты: H2SO4 – производство минеральных удобрений, соляной, уксусной и многих других кислот, моющих средств,
- 21. Применение солей серной кислоты: H2SO4 – используют в качестве минеральных удобрений; – в строительстве; – для
- 22. Получение серной кислоты на производстве S + O2 = SO2 2H2S + 3O2 = 2SO2 +
- 24. Скачать презентацию













 Составление формул солей
Составление формул солей Кроссворд. Плотность
Кроссворд. Плотность Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Соли (8 класс)
Соли (8 класс) Электролитическая диссоциация
Электролитическая диссоциация Строение атома. Химия, 8 класс
Строение атома. Химия, 8 класс Учебная мотивация как показатель качества образования (на уроках химии)
Учебная мотивация как показатель качества образования (на уроках химии) Калий. В природе
Калий. В природе Скорость химической реакции
Скорость химической реакции Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Циклоалканы. Физические свойства
Циклоалканы. Физические свойства Органические цепочки
Органические цепочки 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov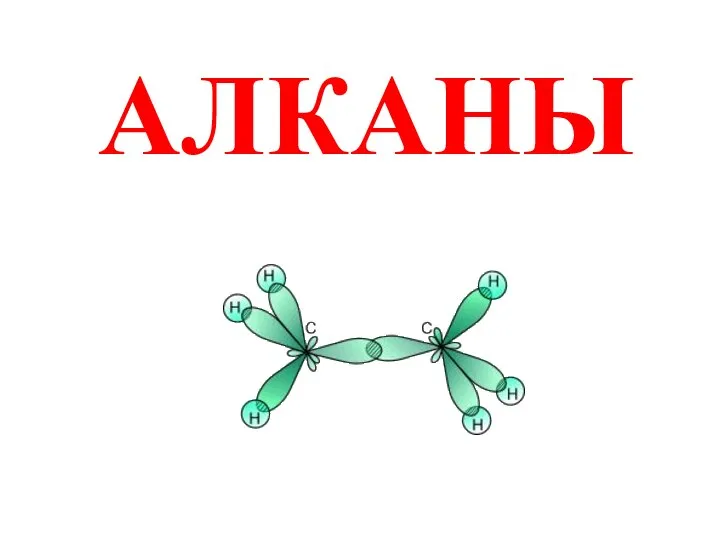 Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Пористые стекла
Пористые стекла Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Круговорот азота в природе
Круговорот азота в природе Увлекательный мир химии
Увлекательный мир химии Органика в ЕГЭ (В,С)
Органика в ЕГЭ (В,С) Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  Определение качества дизельного топлива
Определение качества дизельного топлива Водород. Доклад по химии
Водород. Доклад по химии Две стороны личности: композитор и ученый-химик
Две стороны личности: композитор и ученый-химик Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Соли
Соли Коштовне каміння
Коштовне каміння