Слайд 2Алкины – это непредельные углеводороды, содержащие одну тройную связь.
Общая формула гомологического ряда

Сn Н2n-2
Слайд 3 Строение
Sp - гибридизация
Н – С – С –
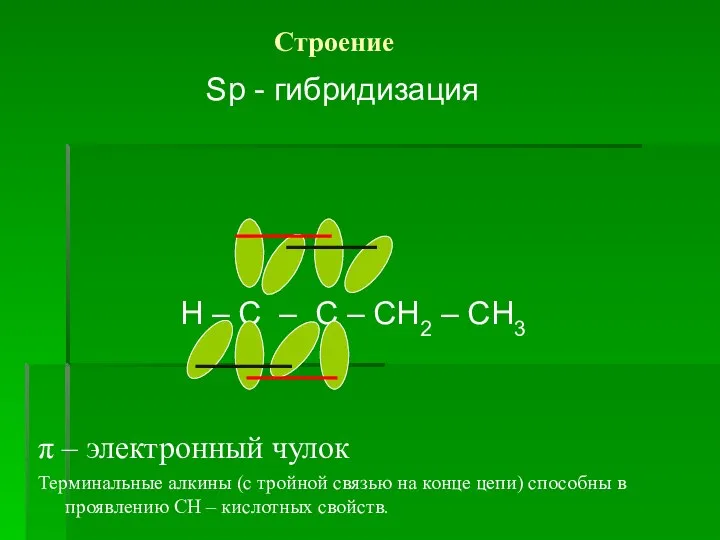
СН2 – СН3
π – электронный чулок
Терминальные алкины (с тройной связью на конце цепи) способны в проявлению СН – кислотных свойств.
Слайд 4 Номенклатура
1 2 3 4 5
СН ≡ С – СН2
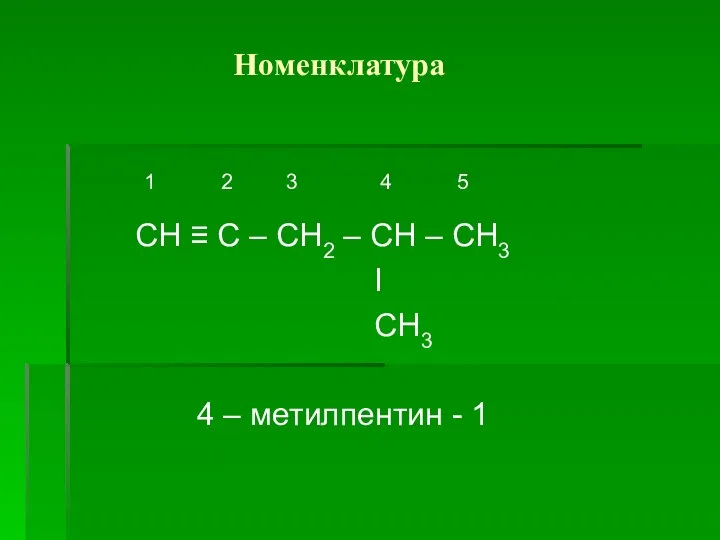
– СН – СН3
I
СН3
4 – метилпентин - 1
Слайд 5 Изомерия
1. Структурная:
а) Углеродного скелета
НС ≡ С – СН2 – СН2
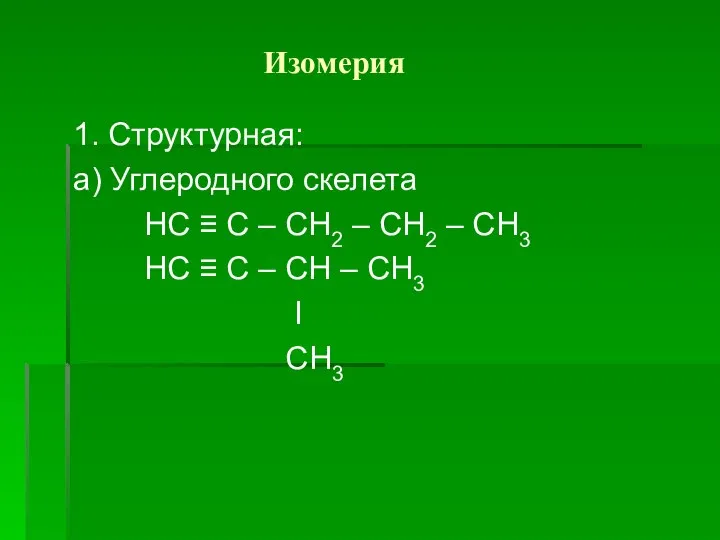
– СН3
НС ≡ С – СН – СН3
I
СН3
Слайд 6б) положения кратной связи
НС ≡ С – СН2 – СН3
СН3

– С ≡ С – СН3
2. Межклассовая
СН3 – С ≡ С – СН3
СН2 = СН – СН = СН2 бутадиен -1,3
СН – СН2 циклобутен
II I
CН – СН2
Слайд 7 Методы получения
1. Неполный пиролиз метана
15000
2СН4 С2 Н2 + 3Н2
2.

Карбидный
СаС2 + 2 Н2О Са(ОН)2 + С2 Н2
t
СаО + 3С СаС2 + СО
Слайд 83. Дегидрогалогенирование дигалогеналканов
спирт
СН2 – СН2 + 2КОН С2Н2 + 2КВr +

Н2О
I I
Br Br
спирт
Br - СН – СН3 + 2 КОН С2Н2 + 2КВr + Н2О
I
Br
Слайд 94. Дегалогенирование тетрагалогеналканов с цинком
2 Zn
Br - СН – СН

– Br C2H2
I I - 2 ZnBr2
Br Br
5. Взаимодействие алкилгалогенидов с ацетиленидами
СН3 – С ≡ С – Аg + СН3Br СН3С ≡ С – СН3 + АgBr
Слайд 10 Физические свойства
С2Н2 – бесцветный газ, малорастворим в воде, на воздухе

горит коптящим пламенем. Чистый С2Н2 не имеет запаха.
Слайд 11 Химические свойства алкинов
1. Окисление
а) полное (горение)
2 С2Н2 + 5 О2 →

4СО2 + 2 Н2О + 2600 кДж
б) неполное
3С2Н2 + 8 КМnО4 (водный) → 3КООС – СООК + 8МnО2 + 2КОН + 2Н2О
5СН3 – СН2 – С ≡ С – СН3 + 6КМnО4 +
9Н2 SО4 → 5СН3СН2СООН + 5СН3СООН + 6МnSО4 + 3 К2SО4 + 4Н2О
Слайд 122. Присоединение
Ni, H2, t
а) С2Н2 → С2Н6
б) С2Н2 + 2Вr2 →

СНВr2 – CHBr2
в) С2Н2 +НСI → СН2 = СН – СI (I стадия)
СН2 = СНСI +НСI → СН3 - СНСI (II стадия)
по правилу Марковникова
3. Реакция Кучерова
Нg2+, Н+
НС≡СН + Н2О → СН2 = СН → СН3 С =О
I I
ОН Н
виниловый спирт ацетальдегид
Слайд 134. Тримеризация (реакция Бертло-Зелинского)
500, С акт.
3 С2Н2 →
бензол
5.
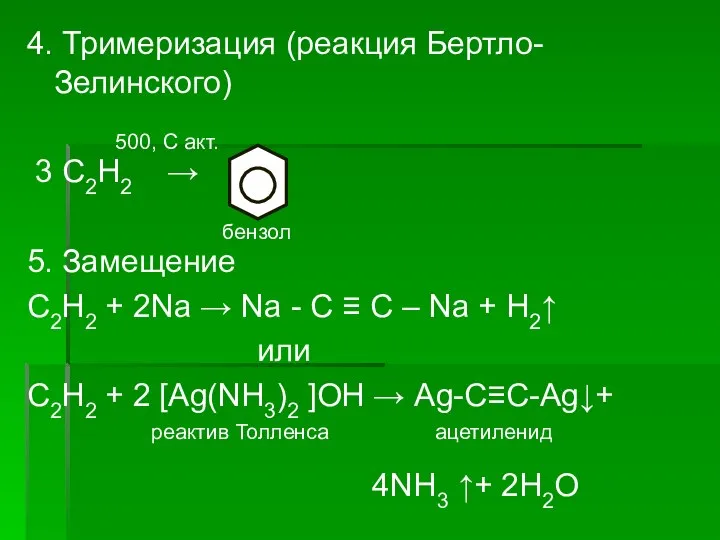
Замещение
С2Н2 + 2Nа → Nа - С ≡ С – Nа + Н2↑
или
С2Н2 + 2 [Аg(NН3)2 ]ОН → Аg-С≡С-Аg↓+
реактив Толленса ацетиленид
4NН3 ↑+ 2Н2О
Слайд 14 Применение ацетилена в промышленности
бензол СН3 – С = О
I
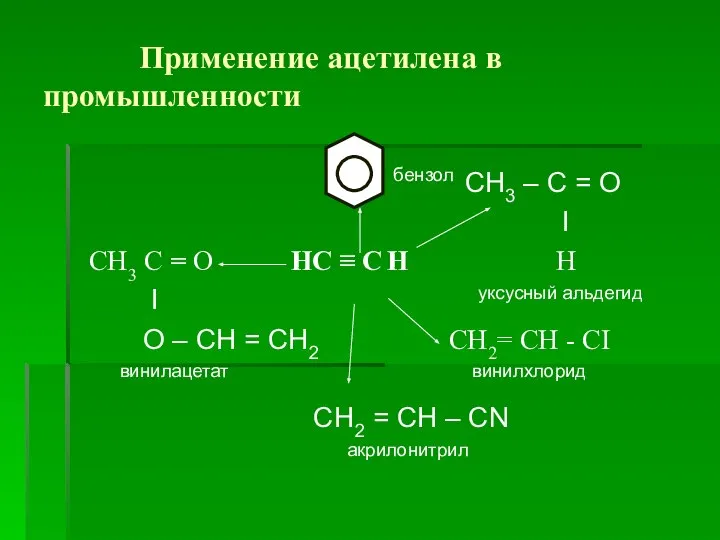
СН3 С = О НС ≡ С Н Н
I уксусный альдегид
О – СН = СН2 СН2= СН - СI
винилацетат винилхлорид
СН2 = СН – СN
акрилонитрил













 Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Типы кристаллических решёток
Типы кристаллических решёток Предмет химии. Вещества
Предмет химии. Вещества Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Экологические характеристики ДВС
Экологические характеристики ДВС Твердые электролиты
Твердые электролиты Ароматические углеводороды
Ароматические углеводороды Производство серной кислоты
Производство серной кислоты Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций 1 Класифікація_Завада_лекция 1_укр_2018(1)
1 Класифікація_Завада_лекция 1_укр_2018(1) Выращивание кристаллов
Выращивание кристаллов Карбоновые кислоты
Карбоновые кислоты Применение серы, хлора, углерода
Применение серы, хлора, углерода Спирт и его влияние на организм человека
Спирт и его влияние на организм человека 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Дифференциальный термический анализ
Дифференциальный термический анализ Минералы. Самородные элементы
Минералы. Самородные элементы Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Хлорорганические соединения
Хлорорганические соединения Степень окисления
Степень окисления Алкадиены
Алкадиены Решение расчетных задач
Решение расчетных задач Тесты для самопроверки
Тесты для самопроверки Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами
Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами