Содержание
- 2. Электрохимические процессы Электрохимический процесс - окислительно-восстановительный процесс, представляющий совокупность процессов окисления и восстановления, (разделенных в пространстве)
- 3. Me0 + mH2O = Me(H2O) mn+ + ne̶ При погружении металла в воду атомы металла, находящиеся
- 4. По мере перехода ионов металла в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора,
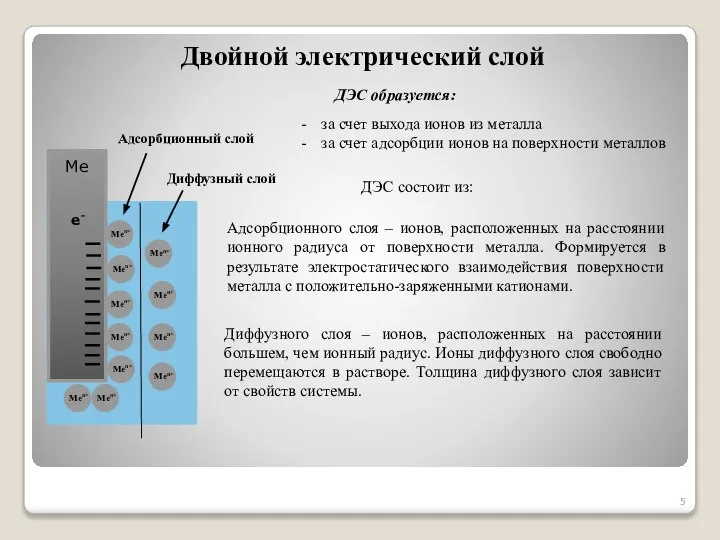
- 5. ДЭС образуется: за счет выхода ионов из металла за счет адсорбции ионов на поверхности металлов ДЭС
- 6. Электроды и электродные потенциалы Образование двойного электрического слоя на границе металл / раствор электролита Электродами называются
- 7. Электродным потенциалом (φ) называют максимальную разность потенциалов, возникающую на границе металл ̶ раствор в момент установления
- 8. Величина электродного потенциала зависит от: Электроды и электродные потенциалы - концентрации ионов металла в растворе: чем
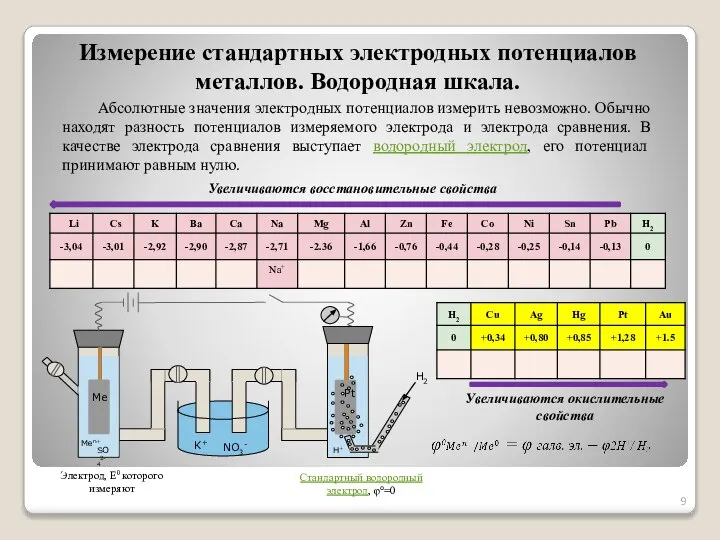
- 9. Абсолютные значения электродных потенциалов измерить невозможно. Обычно находят разность потенциалов измеряемого электрода и электрода сравнения. В
- 10. Электродные потенциалы металлов. Уравнение Нернста При условиях, отличающихся от стандартных, электродные потенциалы вычисляют по уравнению Нернста:
- 11. Определение электродных потенциалов. Решение задач. Условие: определите электродный потенциал медного электрода, погруженного в раствор медного купороса
- 12. Определение электродных потенциалов. Решение задач. Условие: вычислите концентрацию ионов цинка в растворе, если известно, что электродный
- 13. Гальванические элементы Реагенты, входящие в состав гальванического элемента, расходуются в процессе его работы, и действие прекращается
- 14. Классификация гальванических элементов Электрохимические ГЭ – гальванические элементы, источником электрической энергии в которых является химическая реакция
- 15. Термодинамика гальванического элемента Электродвижущая сила гальванического элемента Е (ЭДС) – максимальное значение напряжения – разности между
- 16. Термодинамика гальванического элемента Изменение энергии Гиббса ∆GТ химической реакции вида: aA+bB = cC+dD, зависит от активностей
- 17. Гальванические элементы. Решение задач. Условие: вычислите ЭДС гальванического элемента, состоящего из металлического цинка, погруженного в раствор
- 18. Гальванические элементы. Решение задач. Условие: в каком направлении будет протекать реакция Mn + Ni2+ Mn2+ +
- 19. Электрохимические цепи. Электроды. Решение задач. Условие: Рассчитайте константу равновесия реакции ZnSO4 + Cd = CdSO4 +
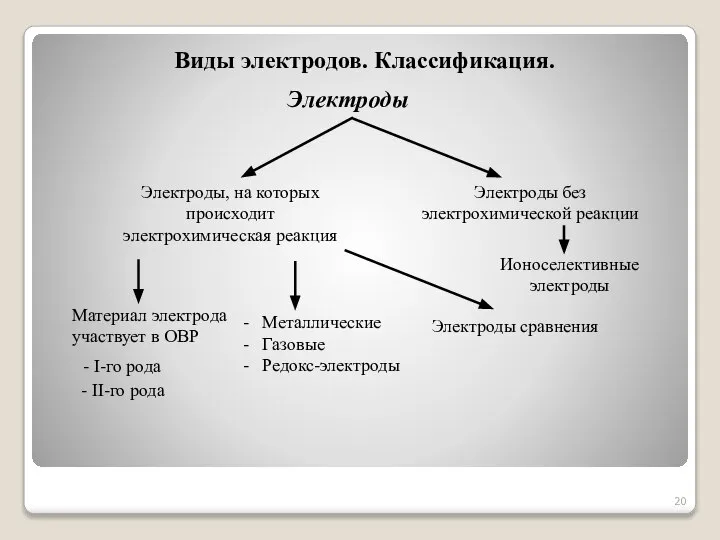
- 20. Виды электродов. Классификация. Электроды Электроды, на которых происходит электрохимическая реакция Электроды без электрохимической реакции - I-го
- 21. Электроды I-го рода Электроды I-го рода – электроды, находящиеся в равновесии с катионами, одноименными с металлом,
- 22. Электроды II-го рода Электроды II-го рода – электроды, состоящие из металла, покрытого слоем его труднорастворимой соли,
- 23. Стандартный водородный электрод Стандартный водородный электрод– электрод, состоящий из платиновой пластинки, покрытой платиновой чернью, опущенной в
- 24. Окислительно-восстановительные электроды Окислительно-восстановительная система (Red-Ox система) – раствор, содержащий одновременно окисленную и восстановленную формы вещества Общая
- 25. Классификация Red-Ox-электродов Схема электрода: Пример: платиновая пластина, погруженная в раствор сульфата железа (II) и сульфата железа
- 26. Классификация Red-Ox-электродов Сложные Red-Ox электроды – электроды, в которых для осуществления электродной реакции кроме Ox и
- 27. Электроды сравнения Водородный электрод имеет сложную конструкцию и его потенциал зависит от трудно контролируемых факторов, поэтому
- 28. Каломельный электрод – электрод, состоящий из платиновой проволоки, погружённой в каплю ртути, помещённой в насыщенный каломелью
- 29. Ионселективные (мембранные) электроды Ионселективные электроды – электрохимические системы, в которых потенциал определяется процессами распределения ионов между
- 30. Электрохимические цепи. Электроды. Решение задач. Условие: составьте концентрационный элемент с переносом заряда из железных электродов (Fe3+|Fe).
- 31. 1. Вычисляем значения электродных потенциалов, определяем анод и катод гальванического элемента: Электрохимические цепи. Электроды. Решение задач.
- 32. 3. Запишем процессы, протекающие на электродах: Анод: Ni − 2e− ⇄ Ni2+ | 1 Катод: NO3−
- 33. Электрохимические цепи. Электроды. Решение задач. Условие: как изменится потенциал водородного электрода, опущенного в чистую воду при
- 34. 5. Найдем значение рН в растворе H2SO4: Электрохимические цепи. Электроды. Решение задач. νэкв. = Cн·V =
- 35. Электролиз Электролиз - окислительно-восстановительное разложение вещества под действием проходящего через него постоянного электрического тока. Электролиз возможен
- 36. Электролиз. Типы анодов Аноды Нерастворимые (инертные) Анодные процессы могут происходить по-разному в зависимости от материала анода
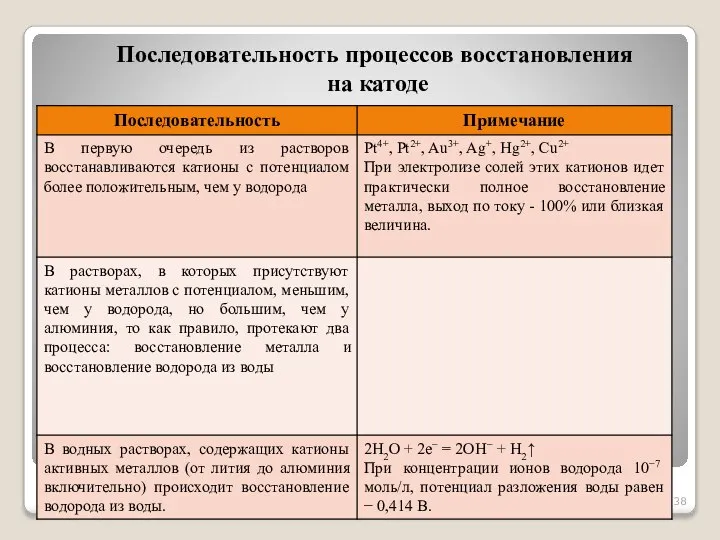
- 37. При наличии в растворе нескольких типов катионов на катоде в первую очередь восстанавливаются те катионы, которым
- 38. Последовательность процессов восстановления на катоде
- 39. Последовательность процессов окисления на аноде
- 40. Схемы электролиза растворов NiCl2 = Ni +Cl2↑ 2 NaCl + 2H2O = 2NaOH + H2↑ +Cl2↑
- 41. Схемы электролиза растворов 2K2SO4 + 6H2O= 4KOH +2H2SO4 +O2↑ NiCl2 +Zn = Ni +ZnCl2
- 42. Схемы электролиза расплавов CuCl2 = Cu +Cl2↑ 2NaCl = 2Na +Cl2↑ 2K2SO4 = 4K +2SO3↑ +
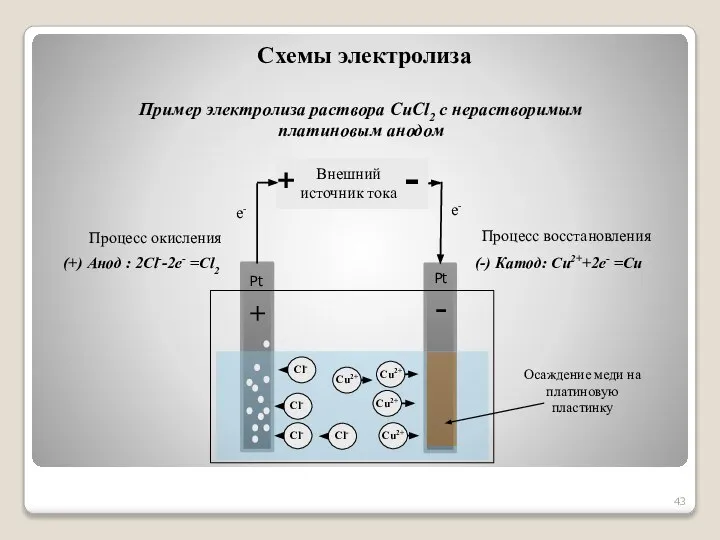
- 43. (+) Анод : 2Cl--2e- =Cl2 (-) Катод: Cu2++2e- =Cu Пример электролиза раствора CuCl2 с нерастворимым платиновым
- 44. Законы электролиза Закон Фарадея: масса вещества, которая выделится на электроде при электролизе, прямо пропорциональна количеству электричества,
- 45. Электролиз. Решение задач. Условие: Какая масса металла выделится на катоде и какой объем газа выделится на
- 46. Электролиз. Решение задач. Условие: При электролизе водного раствора CuSO4, объемом 2 л, на катоде выделилось 60
- 47. 3. Находим количество меди, находившееся в растворе до электролиза: Электролиз. Решение задач. ν1 = ν2+ ν
- 48. Лебедев О.А. Конспект лекций по курсу «Химия». – СПб: СПбГЭТУ «ЛЭТИ». – 2007. – 250 с.
- 49. Активность. Активность (а) – величина, введенная для учета взаимного притяжения ионов в растворе, а также взаимодействия
- 51. Скачать презентацию











































 Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот Минерал дунит
Минерал дунит Удивительное рядом
Удивительное рядом Свойства алкенов
Свойства алкенов Теоретико-графовый анализ информативности кинетических параметров механизмов химических реакций
Теоретико-графовый анализ информативности кинетических параметров механизмов химических реакций Exotermické a endotermické reakcie
Exotermické a endotermické reakcie Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Презентация на тему Полисахариды. Крахмал и целюлоза
Презентация на тему Полисахариды. Крахмал и целюлоза  Нитробактерии. Нитратное дыхание
Нитробактерии. Нитратное дыхание Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Презентация на тему Важнейшие классы неорганических соединений
Презентация на тему Важнейшие классы неорганических соединений  Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Получение и свойства кислорода. Практическая работа
Получение и свойства кислорода. Практическая работа ad8c00e7ea114b35a6fc29426ea31646 (1)
ad8c00e7ea114b35a6fc29426ea31646 (1) Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11) Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Циклические эфиры (окиси)
Циклические эфиры (окиси) Вода. Растворы
Вода. Растворы Алкан бутан (C4H10)
Алкан бутан (C4H10) Первоначальные химические понятия
Первоначальные химические понятия Знакомство с химической посудой и лабораторным оборудованием. Правила техники безопасности
Знакомство с химической посудой и лабораторным оборудованием. Правила техники безопасности Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Загадочный фосфор
Загадочный фосфор рН розчину
рН розчину Уретановый каучук
Уретановый каучук Увлекательный мир химии
Увлекательный мир химии Производство серной кислоты
Производство серной кислоты