Содержание
- 2. КЛАССИФИКАЦИЯ ДИЕНОВ По расположению двойных связей: К Л А С С И Ф И К А
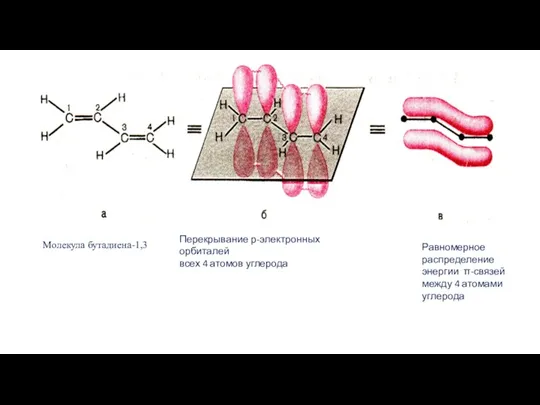
- 3. СТРОЕНИЕ СОПРЯЖЕННЫХ ДИЕНОВ Рассмотрим особенности строения сопряженных алкадиенов на примере бутадиена-1,3 СН2 = СН - СН
- 4. Для ответа на этот вопрос рассмотрим углеродный скелет соединения: С = С ⸺ С = С
- 5. Оказывается, р-электронные орбитали образуют еще дополнительное перекрывание между атомами углерода С2 и С3. Почему? Это происходит
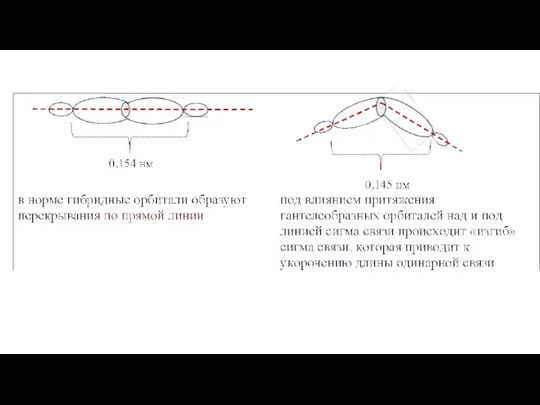
- 6. В результате притягивания соседних орбиталей С2 и С3: - площади перекрывания р-орбиталей между углеродами С1 и
- 8. Молекула бутадиена-1,3 Равномерное распределение энергии π-связей между 4 атомами углерода Перекрывание р-электронных орбиталей всех 4 атомов
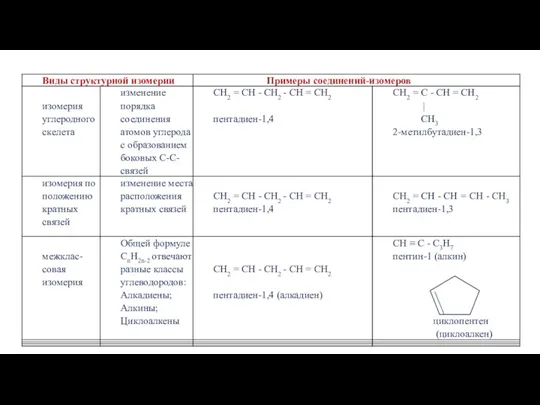
- 9. И З О М Е Р И Я А Л К А Д И Е Н
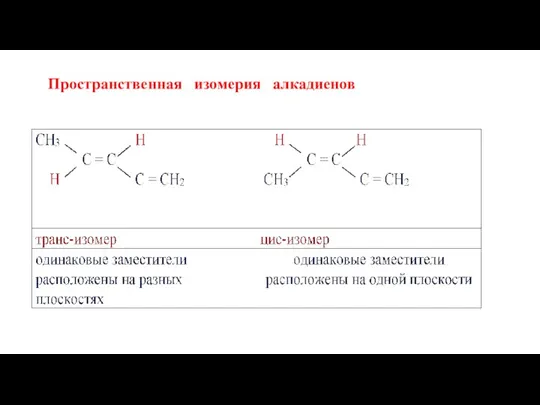
- 11. Пространственная изомерия алкадиенов
- 12. ХИМИЧЕСКИЕ СВОЙСТВА СОПРЯЖЕННЫХ ДИЕНОВ Сопряженные диены более устойчивы за счет равномерного распределения избыточной энергии двух π-связей.
- 13. Рассмотрим этапы 1,4-присоединения на примере гидрохлорирования пентадиена-1,3
- 17. Скачать презентацию










 Химическая связь
Химическая связь Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Белки. Химия
Белки. Химия Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Классы неорганических соединений
Классы неорганических соединений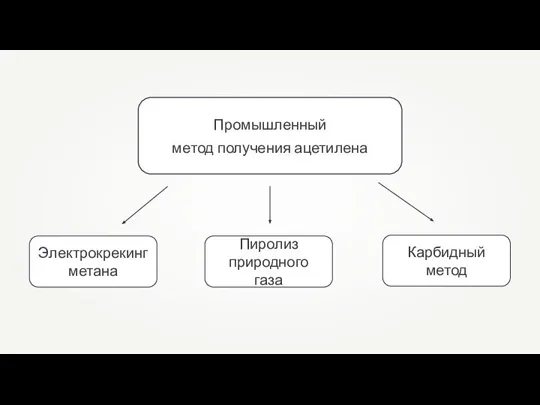 Промышленный метод получения ацетилена
Промышленный метод получения ацетилена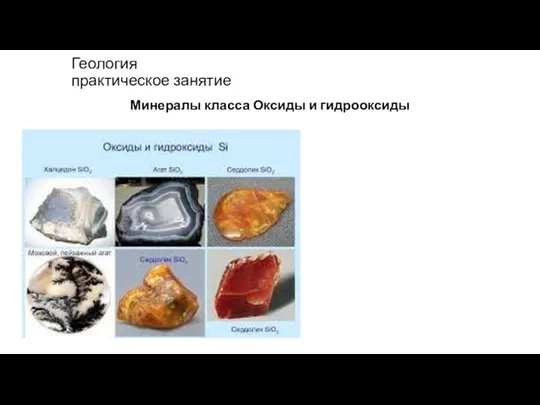 Оксиды и гидрооксиды
Оксиды и гидрооксиды Водород
Водород валентность (1)
валентность (1) Идеальный газ
Идеальный газ Азот, соединения азота
Азот, соединения азота кристаллические решетки (2) (2)
кристаллические решетки (2) (2) Презентация на тему Электролиз
Презентация на тему Электролиз  Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Презентация на тему Неогранические соединения. Периодическая таблица
Презентация на тему Неогранические соединения. Периодическая таблица  Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции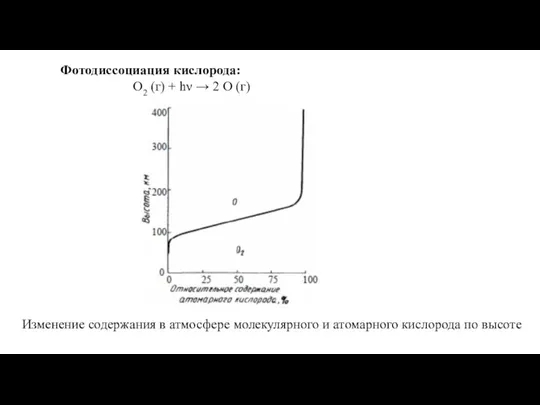 Фотодиссоциация кислорода
Фотодиссоциация кислорода Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы
Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Щелочные металлы
Щелочные металлы Плотность вещества
Плотность вещества Молекулярная химия
Молекулярная химия Башня плотности
Башня плотности Химия в нашем доме. Введение в курс. Урок №1
Химия в нашем доме. Введение в курс. Урок №1 Галогены
Галогены Нітрогеновмісні сполуки
Нітрогеновмісні сполуки