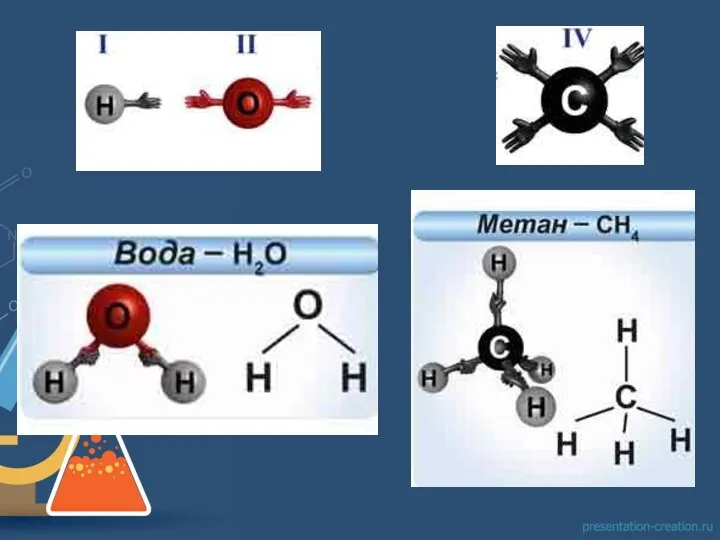
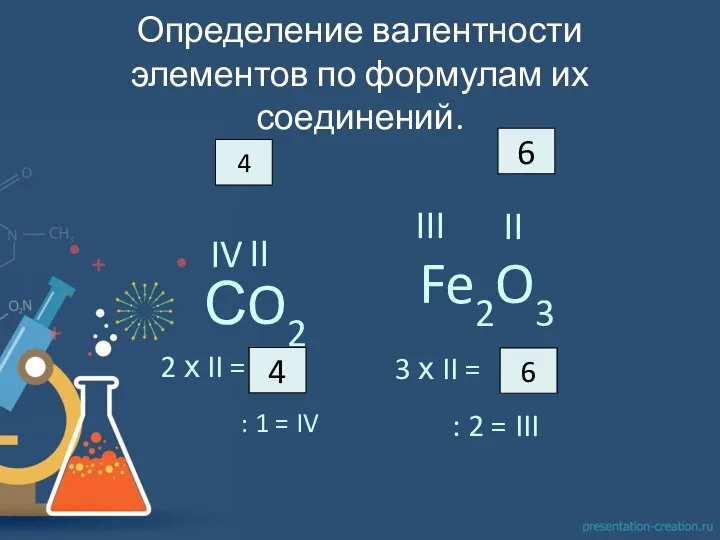
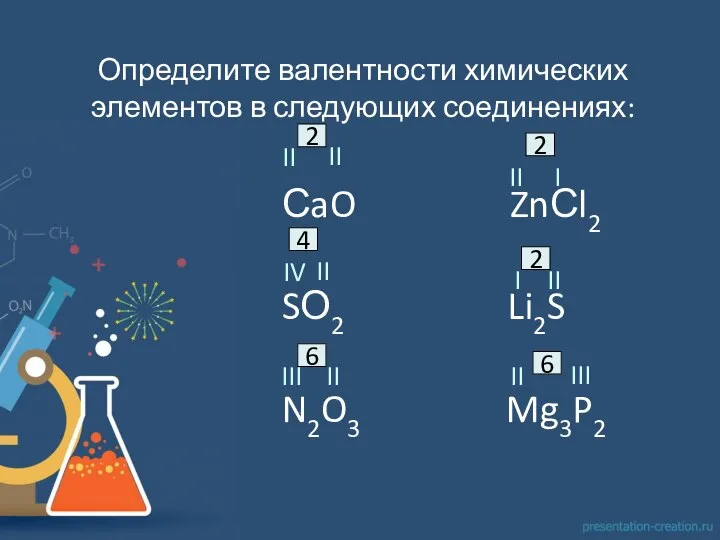
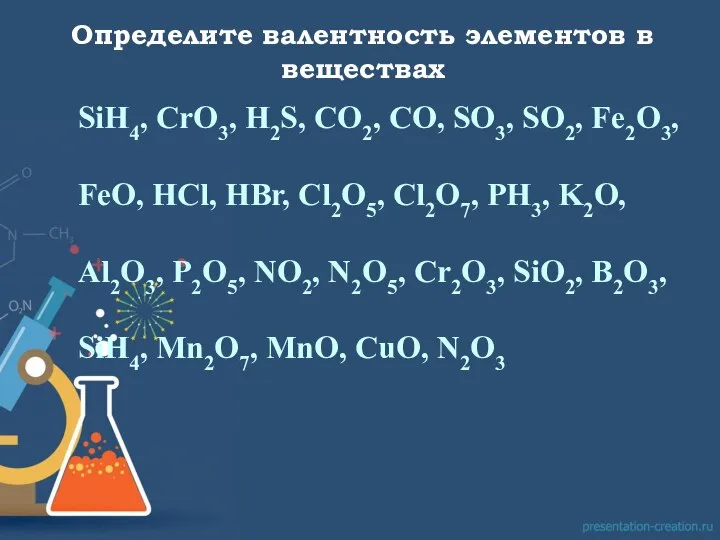
из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
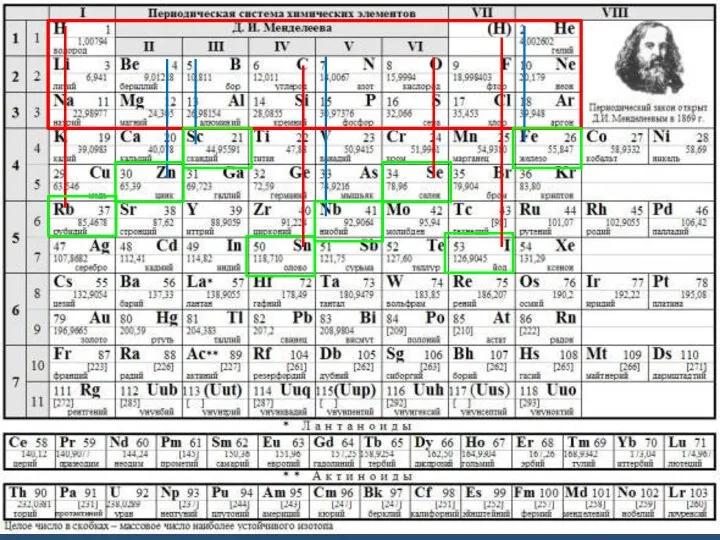
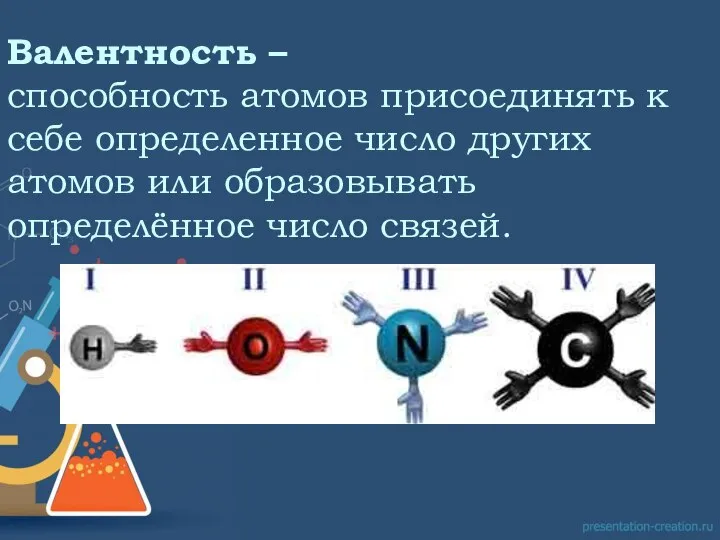
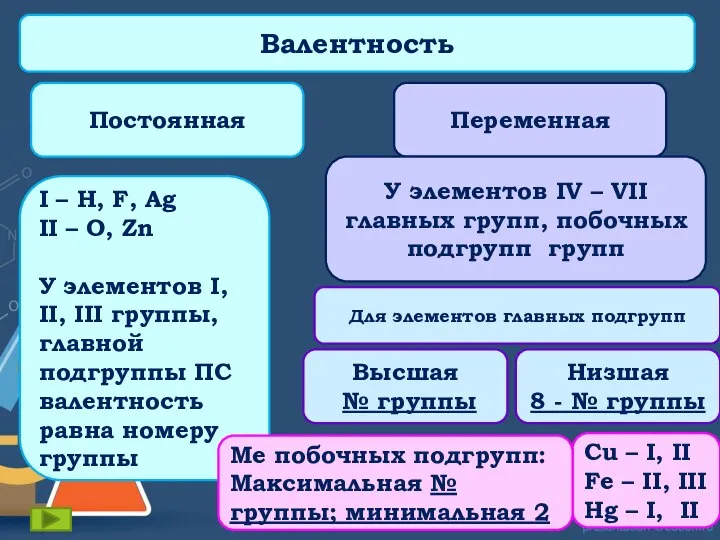
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
Эдуард Франкленд




 Гидролиз солей
Гидролиз солей Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Синтез макромолекул
Синтез макромолекул Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений Приобретённые: недостаточность митохондрий,
Приобретённые: недостаточность митохондрий, Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  ОГЭ — урок
ОГЭ — урок Лекарственные вещества (определения и классификация)
Лекарственные вещества (определения и классификация) Основы МКТ
Основы МКТ Материаловедение для пирсера. Материалы, используемые в пирсинге
Материаловедение для пирсера. Материалы, используемые в пирсинге Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Elektroliz_Gidroliz
Elektroliz_Gidroliz Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Минералы. Лекция 02
Минералы. Лекция 02 Водород – топливо будущего
Водород – топливо будущего Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Современные оборудования в лаборатории
Современные оборудования в лаборатории Алканы
Алканы Электролиз
Электролиз Химико-металлургические методы
Химико-металлургические методы Строение Алкенов
Строение Алкенов Энергетика химических реакций
Энергетика химических реакций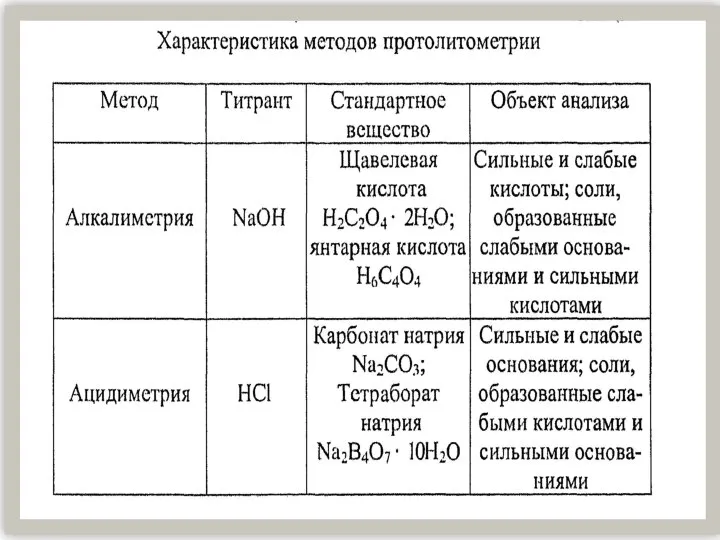 Характеристика методов протолитометрии
Характеристика методов протолитометрии Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Характеристика кислорода и серы
Характеристика кислорода и серы Природные кислоты и щелочи. Индикаторы
Природные кислоты и щелочи. Индикаторы 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性