Содержание
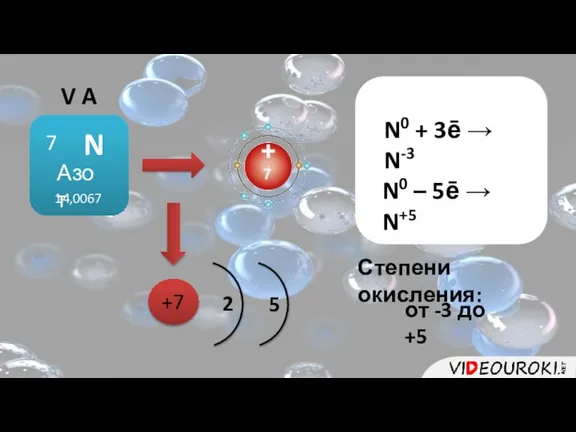
- 2. V A N0 + 3ē → N-3 N0 – 5ē → N+5 +7 2 5 Степени
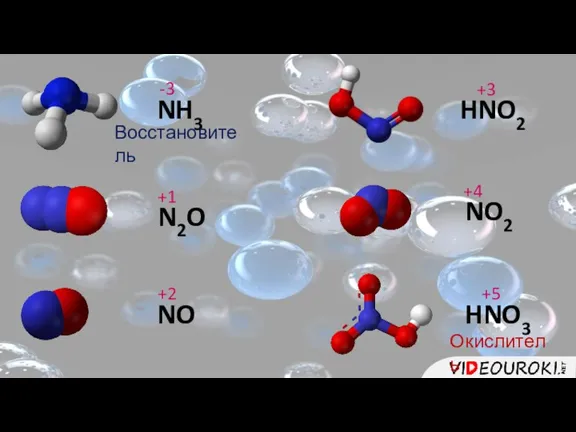
- 3. NH3 -3 N2O +1 NO +2 HNO2 +3 NO2 +4 HNO3 +5 Восстановитель Окислитель
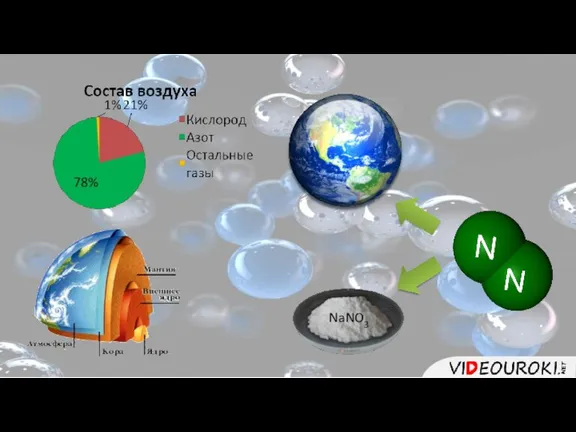
- 4. NaNO3
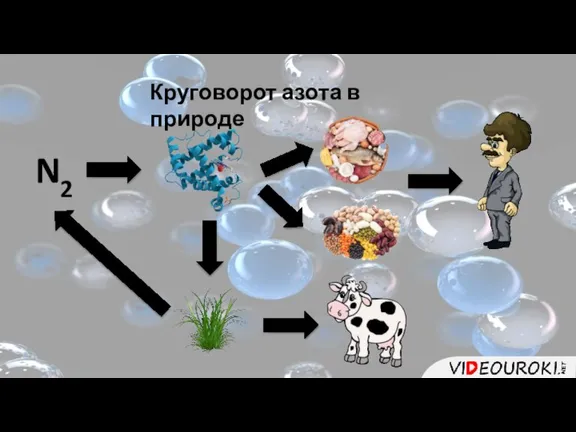
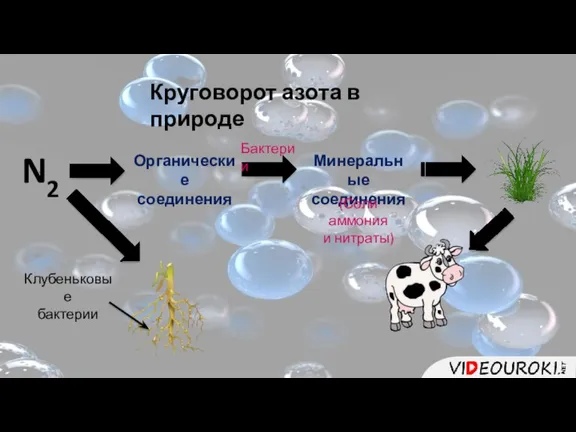
- 5. Круговорот азота в природе N2
- 6. Круговорот азота в природе N2 Органические соединения Минеральные соединения Бактерии (Соли аммония и нитраты) Клубеньковые бактерии
- 7. N2 + O2 ↔ 2NO 2NO + O2 ↔ 2NO2 4NO2 + O2 + 2H2O =
- 8. N2 Азот – малоактивное вещество. Азот является бесцветным газом, не имеет запаха и вкуса. Не сжижается
- 9. Химические свойства азота 1. Реакции с металлами 6Li + N2 = 2Li3N 0 0 +1 -3
- 10. 3. Реакция с кислородом Химические свойства азота 0 0 +2 -2 Восст-ль оксид азота (II) Ок-ль
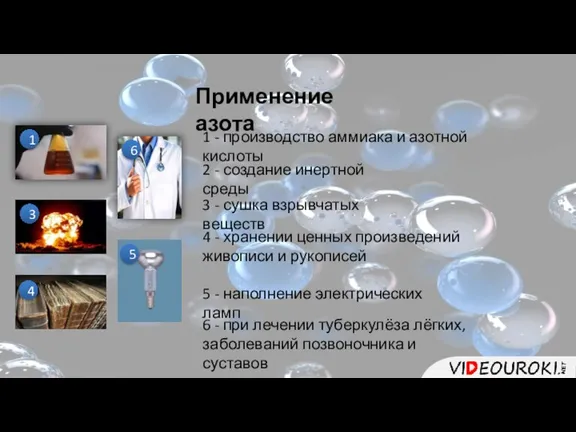
- 11. Применение азота 1 1 - производство аммиака и азотной кислоты 2 2 - создание инертной среды
- 12. Д. Резерфорд В 1772 г. в экспериментах по сжиганию веществ обнаружили газ, не поддерживающий дыхание и
- 13. Определите массу соединения, которое образуется при нагревании металлического магния массой 7,2 г в азоте объёмом (н.у.)
- 15. Скачать презентацию






 Рівноваги у розчинах електролітів
Рівноваги у розчинах електролітів Карбоновые кислоты
Карбоновые кислоты Структура к свойства веществ
Структура к свойства веществ Циклоалканы
Циклоалканы Получение бутандиола, как способ переработки природного газа
Получение бутандиола, как способ переработки природного газа Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Алюминий и его соединения
Алюминий и его соединения Строение электронных оболочек атомов. Электроны в атоме
Строение электронных оболочек атомов. Электроны в атоме Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Карбоновые кислоты
Карбоновые кислоты Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота  Строение атома. Распределение электронов
Строение атома. Распределение электронов Химическая кинетика
Химическая кинетика Парафины. Алканы
Парафины. Алканы Вирощування кристалів солей
Вирощування кристалів солей Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Простые эфиры и перекиси
Простые эфиры и перекиси Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Сахар-рафинад
Сахар-рафинад Признаки химических реакций
Признаки химических реакций Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе «СберСтарЭнерго» «ЖИДКАЯ РЕЗИНА»
«СберСтарЭнерго» «ЖИДКАЯ РЕЗИНА» каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Оксиды и основания
Оксиды и основания