Содержание
- 2. 3 тетради: Лекции – 96 листов Лабораторные работы – 48 листов Домашние работы – 12-18 листов
- 3. Курс лекций (9 лекций): «Классы неорганических соединений» Продолжение темы «Классы неорганических соединений» + тема «Химический эквивалент»
- 4. Моя группа в ВК: Неорганическая химия СамГТУ
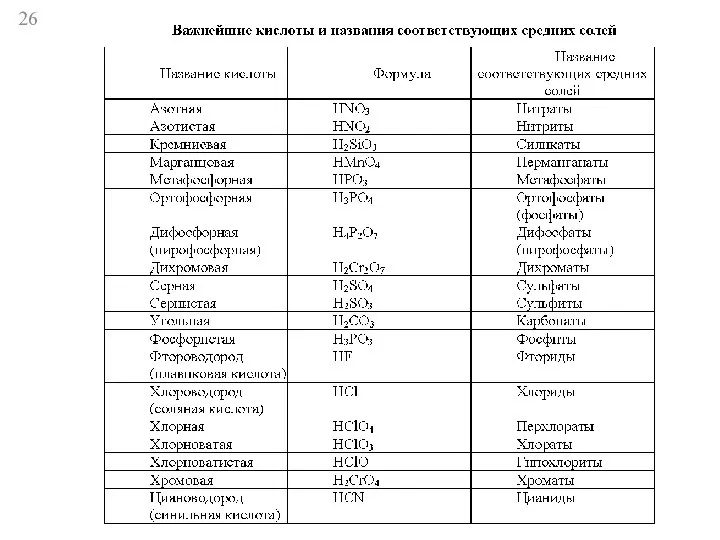
- 5. Литература: И.К. Гаркушин, Н.И. Лисов, А.В. Немков. Общая химия. Н.Л. Глинка. Общая химия. Я.А. Угай. Общая
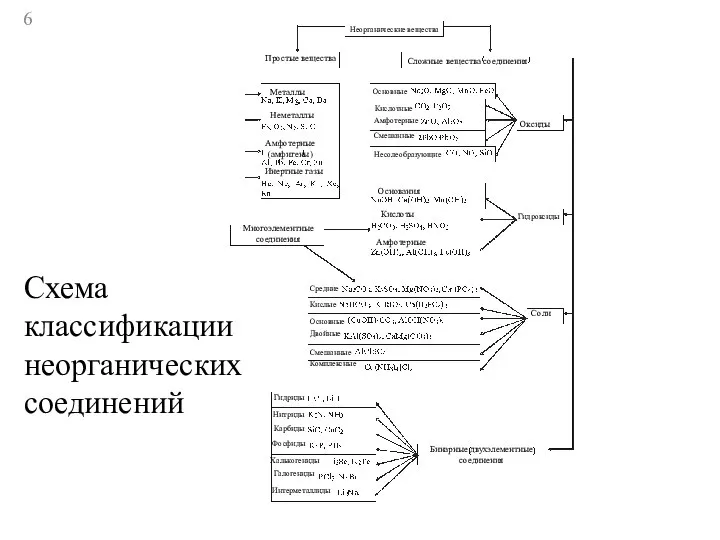
- 6. Неорганические вещества Простые вещества Сложные вещества соединения Металлы Неметаллы Амфотерные (амфигены) Инертные газы Многоэлементные соединения Основные
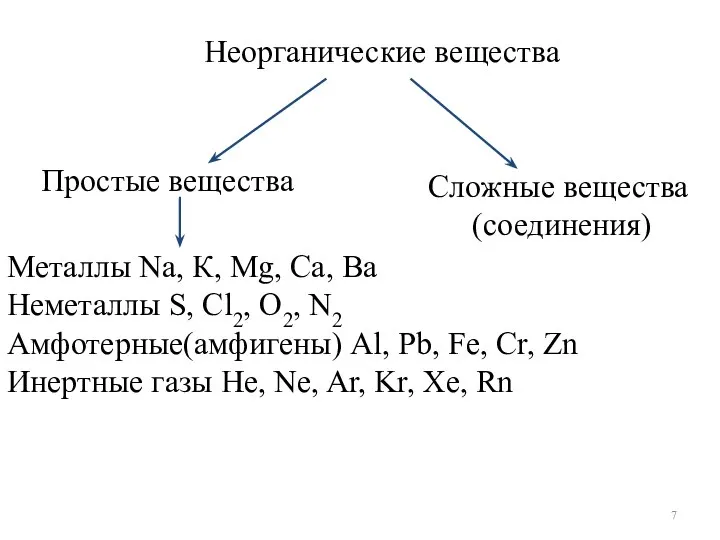
- 7. Простые вещества Неорганические вещества Сложные вещества (соединения) Металлы Na, К, Mg, Ca, Ba Неметаллы S, Cl2,
- 8. Оксиды Солеобразующие Несолеобразующие (индифферентные) основные (о.о.) кислотные (к.о.) амфотерные (а.о.) N2O, NO, SiO, SO, CO (р-элементы
- 9. Основные оксиды СаО + Н2О → Са(ОН)2 Кислотные оксиды SO3 + Н2O = Н2SO4 Амфотерные оксиды
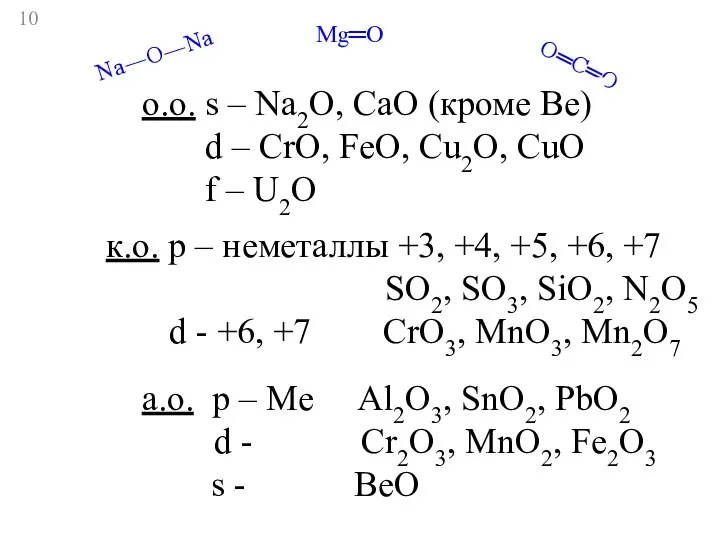
- 10. Mg═O Na―O―Na O═C═O o.о. s – Na2O, CaO (кроме Be) d – CrO, FeO, Cu2O, CuO
- 12. Пероксиды Na―O―O―Na Надпероксиды КO2, группировка атомов O2 имеет заряд – -1 (ст. ок. кислорода равна -1/2).
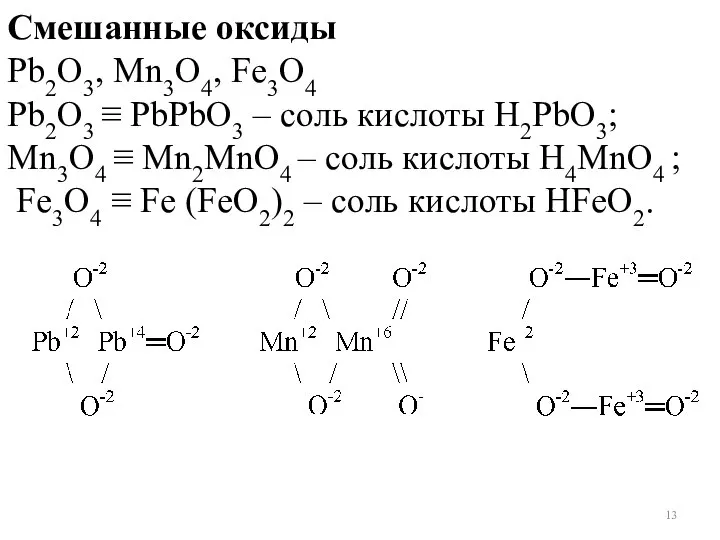
- 13. Смешанные оксиды Pb2O3, Mn3O4, Fe3O4 Pb2O3 ≡ PbPbO3 – соль кислоты Н2PbO3; Mn3O4 ≡ Mn2MnO4 –
- 14. Способы получения оксидов 1. Взаимодействие простых веществ с кислородом 2Mg + O2 → 2MgO S +
- 15. 3. Разложение кислот 4HNO3 = 4NO2 + 2H2O + O2 2H3BO3 = B2O3 +3H2O 4. Разложение
- 16. 5. Разложение оксидов 4СrO3 = 2Cr2O3 +3O2 и окислением оксидов 6PbO + O2= 2Pb3O4 2SO2 +
- 17. 7. Взаимодействие кислот, обладающих окислительными свойствами, с металлами и неметаллами Сu + 4HNO3 = Cu(NO3)2 +
- 19. Химические свойства оксидов СаО + Н2О = Сa(ОН)2 SО3 + H2O = H2SO4 SО3 + Са(ОН)2
- 20. Амфотерные: ZnO + SO3 = ZnSO4 ZnO + 2NaOH + H2O = Na2[Zn(OH)4] ZnO + 2NaOH
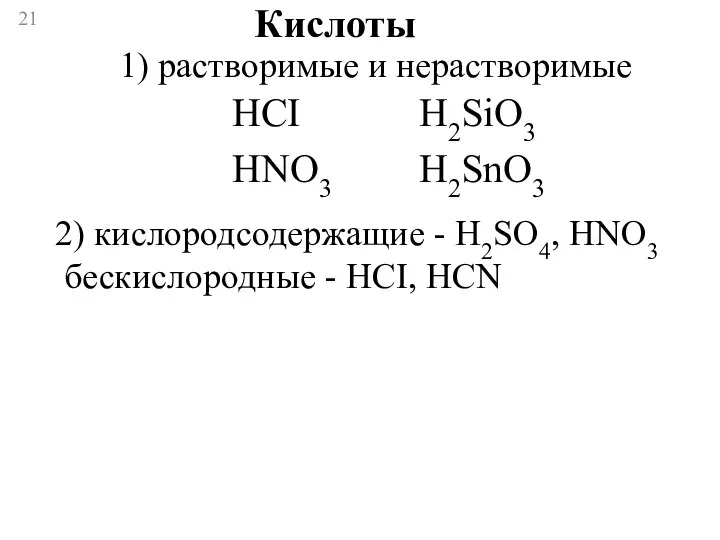
- 21. Кислоты 1) растворимые и нерастворимые HCI HNO3 H2SiO3 H2SnO3 2) кислородсодержащие - H2SO4, HNO3 бескислородные -
- 22. 3) одноосновные - HCI, HNO3, двухосновные - H2S, H2SO4, HNO2 ⇄ H+ + NO2- H2S ⇄
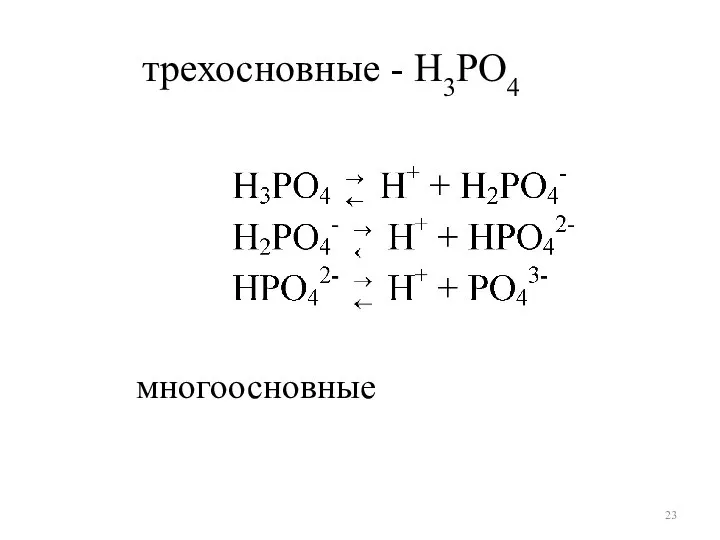
- 23. многоосновные трехосновные - H3РO4
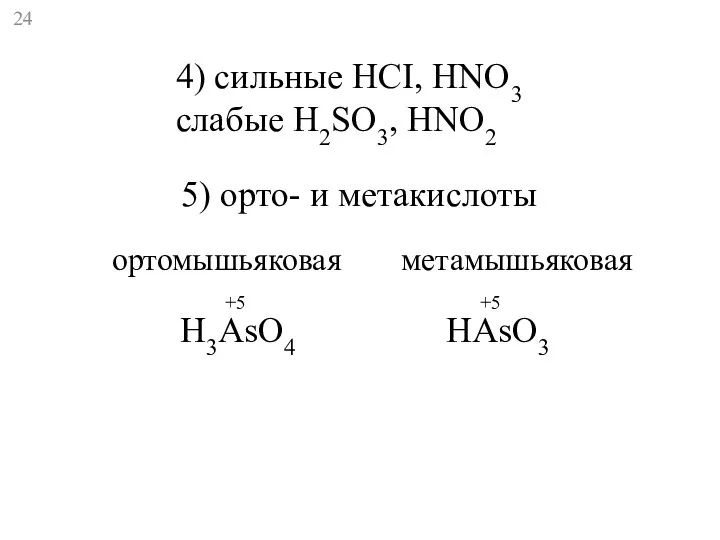
- 24. 4) сильные HCI, HNO3 слабые H2SO3, HNO2 5) орто- и метакислоты H3AsO4 HAsO3 +5 +5 ортомышьяковая
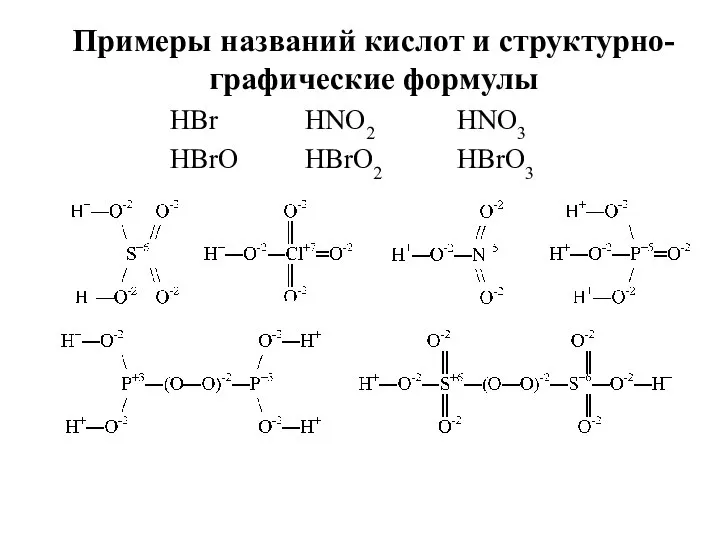
- 25. HBr HBrO HNO2 HBrO2 HNO3 HBrO3 Примеры названий кислот и структурно- графические формулы
- 27. Способы получения кислот Бескислородные кислоты 1. Взаимодействие неметаллов с водородом Н2 + Cl2 = 2HCl Н2
- 28. Кислородсодержащие кислоты 1. Взаимодействие кислотных оксидов с водой SO3 + Н2О = H2SO4 Р2О5 + 3Н2О
- 29. 3. Окисление некоторых простых веществ So + 2HNO3 = H2S6+O4+ 2NO↑ (разб.) 3Р°+ 5НNО3 + 2Н2О
- 30. Химические свойства кислот Взаимодействие с основаниями (реакции нейтрализации) Cu(OH)2↓ + 2HCl = CuCl2 + 2Н2O Взаимодействие
- 31. Взаимодействие с металлами, расположенными в ряду напряжений до водорода 2HCl + Zn = ZnCl2 + H2↑
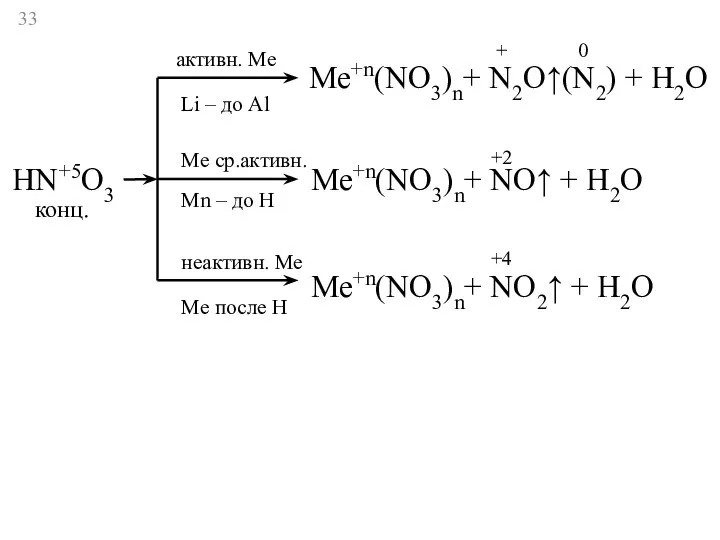
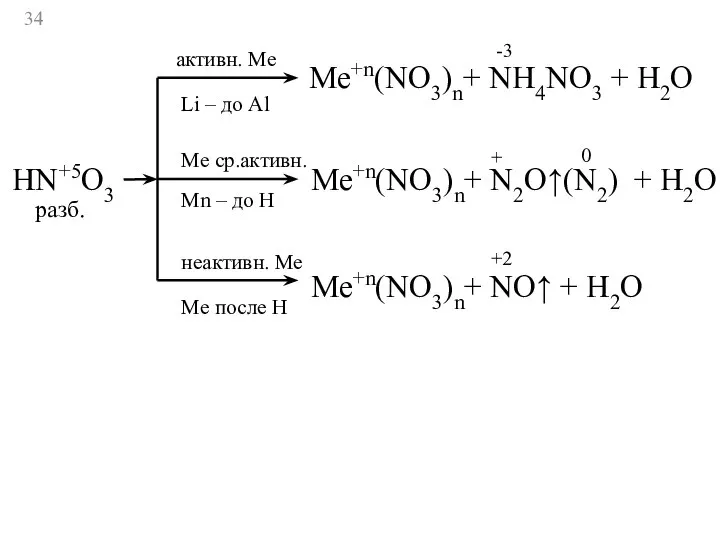
- 33. HN+5O3 активн. Ме Li – до Al Ме ср.активн. Мn – до Н неактивн. Ме Ме
- 34. HN+5O3 активн. Ме Li – до Al Ме ср.активн. Мn – до Н неактивн. Ме Ме
- 35. Основания 3) По кислотности однокислотные - LiOH, KOH, двухкислотные - Ba(OH)2, Fe(OH)2 трехкислотные – Al(OH)3 1)
- 36. Многокислотные основания диссоциируют в несколько ступеней LiOH – (I) (+1) Li2O Cr(OH)2 – (II) (+2) CrO
- 37. 1. Взаимодействие активных металлов и их оксидов с водой Способы получения гидроксидов 2Na +2H2O = 2NaOH
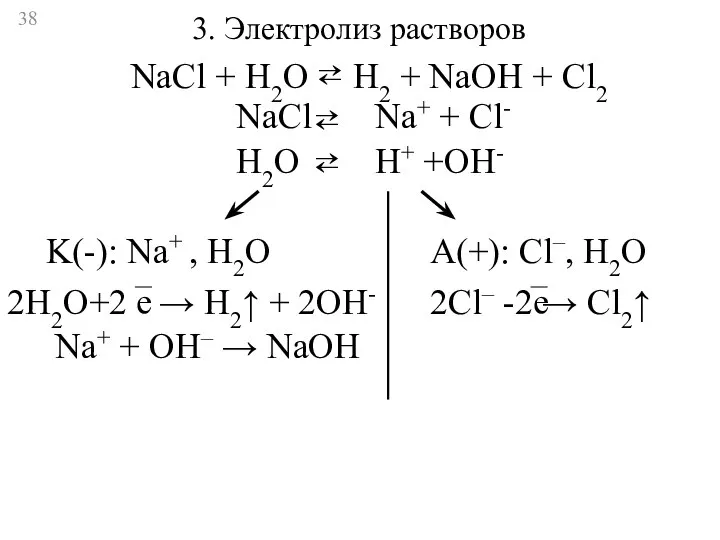
- 38. 3. Электролиз растворов NaCl Na+ + Cl- ⇄ H2O H+ +OH- ⇄ K(-): Na+ , H2O
- 39. Химические свойства оснований Свойства растворимых оснований 1. Zn + 2NaOH + 2Н2О = Na2[Zn(OH)4] + H2↑
- 40. Свойства нерастворимых оснований t Cu(OH)2 = CuO↓ + Н2О 2АgОН = Аg2О + Н2О 3. Гидроксиды
- 41. Амфотерные гидроксиды (амфолиты) Mx+ + xOH- ⇄ M(OH)x ≡ HxMOx ⇄ xH+ + MOxx- основание кислота
- 42. Zn(OH)2 + H2SO4 = ZnSO4+2H2O H2ZnO2 +2KOH = K2ZnO2 +2H2O H3AlO3 + NaOH = NaAlO2 +2H2O
- 44. Соли Средние соли NaCl → Na+ + Сl– хлорид натрия Al2(SO4)3 → 2Al3+ + 3SO42– сульфат
- 45. 2) Двойные соли KAl(SO4)2 ⇄ K+ + Al3+ + 2SO42- AlClSO4 ⇄ Al3+ + Cl- +
- 46. 4) Растворимые – NaCl, KNO3, Rb2SO4 нерастворимые – AgCl, Ca3(PO4)2, BaSO4 3) Смешанные соли CaOCl2 -
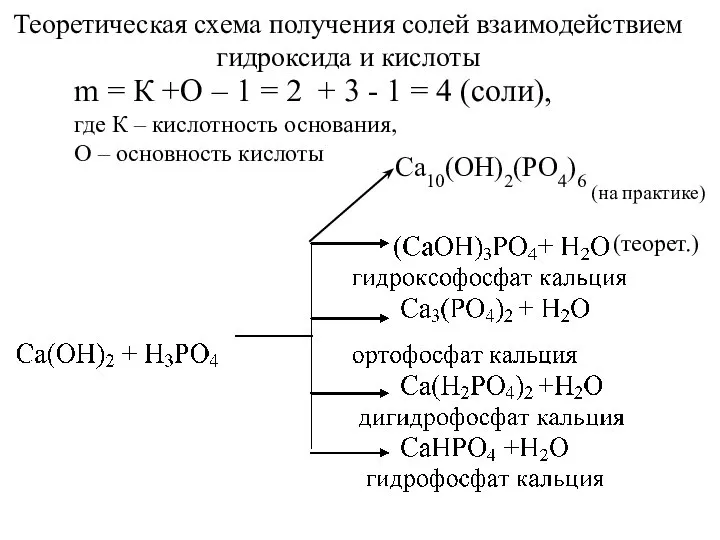
- 47. m = К +О – 1 = 2 + 3 - 1 = 4 (соли), где
- 48. Способы получения солей Взаимодействие металла с кислотой Zn +2HCl = ZnCl2 + H2↑ Взаимодействие основного оксида
- 49. Взаимодействие основного оксида с кислотным CaO + SiO2 = CaSiO3 Взаимодействие гидроксида с кислотным оксидом 2KOH
- 50. Взаимодействие двух солей BaCl2 + Na2SO4 = BaSO4↓+2NaCl Взаимодействие металла с солью Cu + Hg(NO3)2 =
- 51. Взаимодействие металла со щелочью Zn + 2NaOH = Na2ZnO2 + H2↑ Взаимодействие неметалла со щелочью Cl2
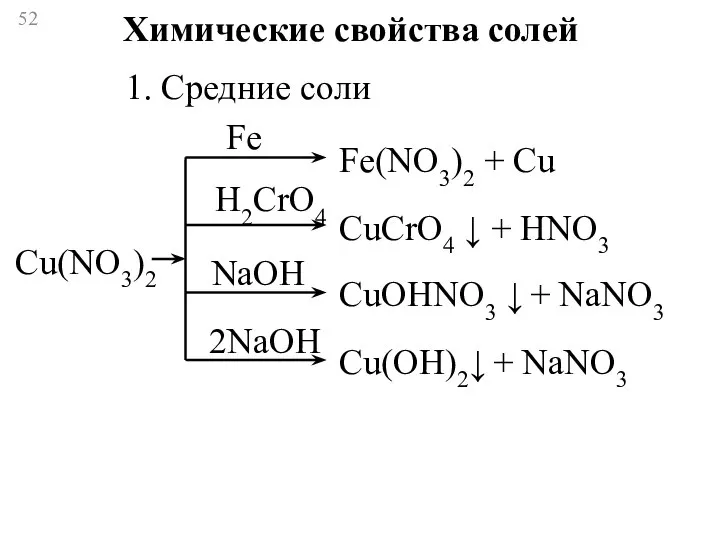
- 52. Химические свойства солей 1. Средние соли Fe H2CrO4 NaOH 2NaOH Cu(NO3)2 Fe(NO3)2 + Cu CuCrO4 ↓
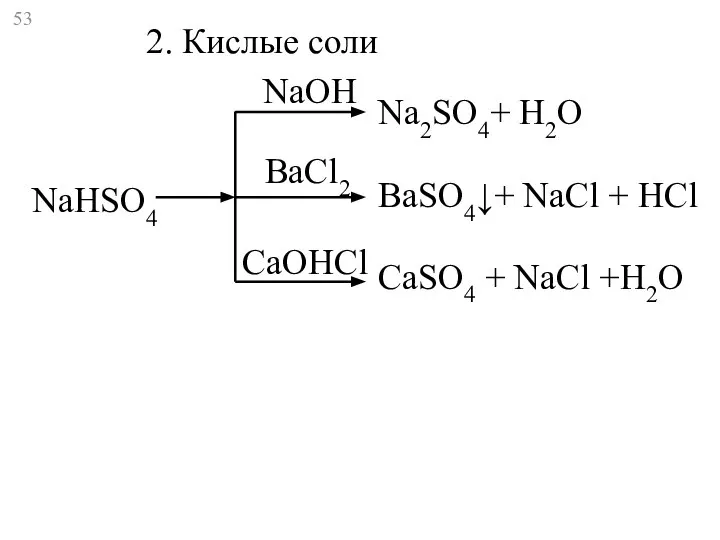
- 53. NaHSO4 Na2SO4+ Н2O BaSO4↓+ NaCl + HCl CaSO4 + NaCl +H2O 2. Кислые соли NaOH BaCl2
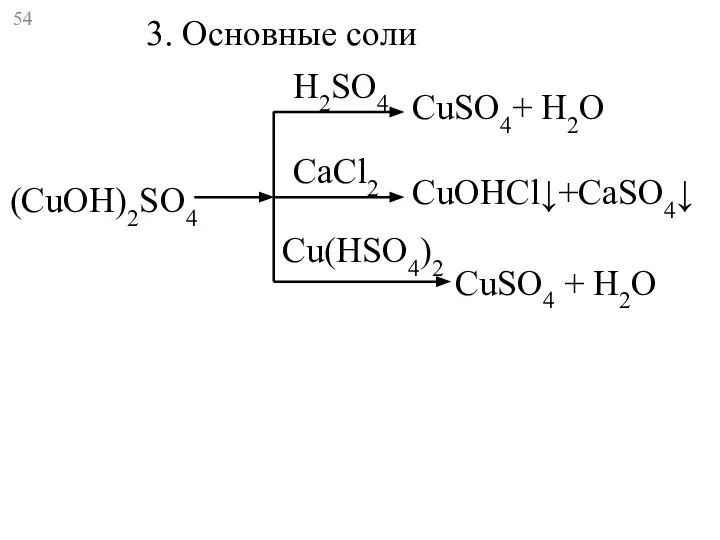
- 54. (CuOH)2SO4 CuSO4+ Н2O CuOHCl↓+CaSO4↓ CuSO4 + H2O H2SO4 CaCl2 Cu(HSO4)2 3. Основные соли
- 55. MgSO4 Mg(HSO4)2 (MgOH)2SO4 MgSO4 + H2SO4 = Mg(HSO4)2 MgSO4 + Mg(OH)2 = (MgOH)2SO4 Mg(HSO4)2 + Mg(OH)2
- 56. Ca ⇒CaO ⇒ Ca(OH)2 ⇒ Ca(HSO4)2 ⇒ CaSO4 ⇒ CaO 2Ca + O2 = 2CaO CaO
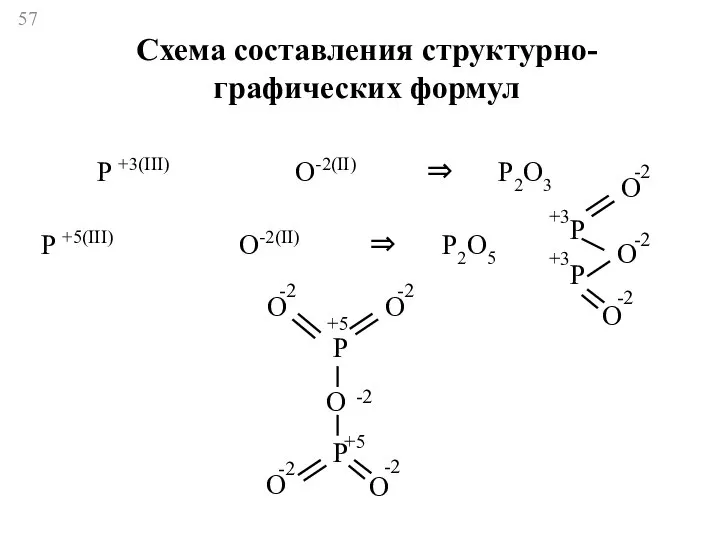
- 57. P +3(III) O-2(II) ⇒ P2O3 O P +5(III) O-2(II) ⇒ P2O5 P P O O -2
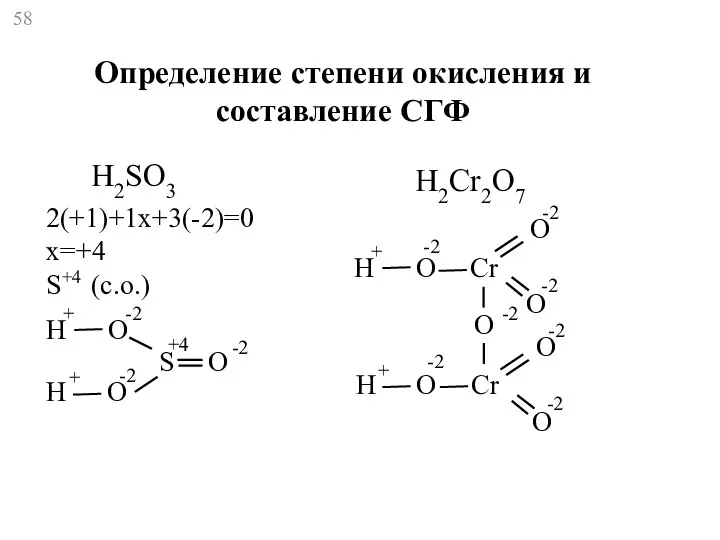
- 58. H2SO3 2(+1)+1x+3(-2)=0 x=+4 S+4 (с.о.) H H O O S O + + -2 -2 -2
- 60. Скачать презентацию













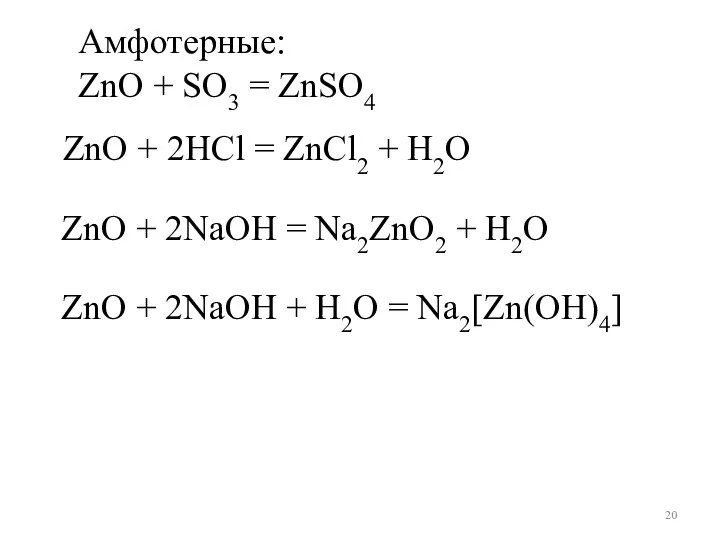
























 Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Свойства Н2
Свойства Н2 ÐÐÐÐ ÐÐТÐÐРХÐÐÐЧÐСÐÐÐ¥ Ð ÐÐÐЦÐÐ
ÐÐÐÐ ÐÐТÐÐРХÐÐÐЧÐСÐÐÐ¥ Ð ÐÐÐЦÐÐ Общие химические свойства металлов
Общие химические свойства металлов Кислород и озон
Кислород и озон Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Коллоидные системы Классификация. Получение. Очистка. Свойства. Устойчивость и коагуляция. Применение
Коллоидные системы Классификация. Получение. Очистка. Свойства. Устойчивость и коагуляция. Применение Химические уравнения
Химические уравнения Вычисления по химическим формулам. Массовая доля элемента в соединении
Вычисления по химическим формулам. Массовая доля элемента в соединении Разбор задач
Разбор задач Круговорот азота в природе
Круговорот азота в природе Основы химии буровых растворов
Основы химии буровых растворов Каучук
Каучук Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Структура материалов. Введение в науку о материалах
Структура материалов. Введение в науку о материалах Спирты (алканолы)
Спирты (алканолы) f8ea0c69dfd043588bd2a8735e944773
f8ea0c69dfd043588bd2a8735e944773 Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Дзержинский политехнический институт. Отчет о работе химической школы
Дзержинский политехнический институт. Отчет о работе химической школы Строение вещества
Строение вещества Изомерия. Классификация органических веществ
Изомерия. Классификация органических веществ Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка
Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка Классификация веществ. Урок №7
Классификация веществ. Урок №7 Классы веществ
Классы веществ Строение вещества
Строение вещества Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье